Рак толстого кишечника (РТК), по данным ВОЗ, занимает третье место по распространенности среди всех онкологических заболеваний, а по количеству смертельных исходов - второе, уступая по этому показателю только раку легкого [1]. В России злокачественные опухоли толстой кишки составляют до 12% от всех других онкологических заболеваний. 40% из впервые выявленных злокачественных новообразований в России имеют III-IV стадии развития заболевания, что обусловливает высокий показатель одногодичной летальности (22,5%) пациентов с данной нозологией [2]. Этот факт актуализирует проблему повышения чувствительности используемых онкомаркеров [3].
Возникновение активирующих соматических мутаций в гене KRAS играет важную роль в прогнозировании успешности применения EGFR-таргетированной терапии. В настоящее время для выявления мутаций в гене KRAS в клинических условиях используются коммерчески доступные сертифицированные наборы с 1-5%-ной аналитической чувствительностью, основанные на аллель-специфической ПЦР в реальном времени или анализе кривой плавления с высоким разрешением [4]. Одним их возможных путей повышения эффективности использования таргетной терапии может служить повышение чувствительности используемых методов детекции соматических мутаций. Технология цифровой ПЦР (ddPCR) обладает высокой чувствительностью. Основанная на микроамплификационных реакциях, которые происходят в нескольких десятках тысяч отдельных микроскопических капель, она обладает намного большей чувствительностью при обнаружении активирующих соматических мутаций [5]. В частности, используя метод ddPCR, Laurent-Puig с соавторами продемонстрировали, что пациенты с метастатическим КРР, имеющие менее 1% KRAS-мутированной фракции, могут получить пользу от анти-EGFR терапии [6]. Пациенты с диким типом гена KRAS также могут демонстрировать устойчивость к персонализированному лечению, что может быть связано с наличием изменений в других генах сигнального пути EGFR или низкой чувствительностью используемых методов детекции мутаций. Частота положительных ответов у таких пациентов ограничена 70% даже для комбинаций с множественной лекарственной химиотерапией [7].
В последние годы в качестве отдельного клинического объекта появился КРР с V600E-мутированным геном BRAF, обычно невосприимчивым к стандартным схемам химиотерапии, одобренным для лечения мРТК, и ассоциированным с плохим прогнозом. Поэтому в настоящее время проводится первое в истории исследование III фазы, в котором оценивается комбинация ингибирования BRAF, EGFR и MEK мишеней [8].
Скрининг активирующих соматических мутаций в 12 и 13 кодонах гена KRAS (наряду с NRAS) рутинно выполняется для пациентов с метастатическим колоректальным раком, поскольку мутации в этих кодонах предсказывают наличие/отсутствие положительного ответа на таргетную терапию EGFR [9]. Поскольку активирующие мутации, расположенные ниже по течению сигнального пути EGFR, также могут играть роль в возникновении устойчивости к терапевтическим воздействиям, целью данного исследования служил комплексный скрининг активирующих соматических мутаций в генах KRAS и BRAF высокочувствительным методом ddPCR в тканях аденокарцином толстой кишки. Увеличение чувствительности используемых методов детекции активирующих соматических мутаций может повысить эффективность лечения пациентов методами таргетной терапии.
Материал и методы исследования
В данное исследование включен материал из 32 операционных биоптатов злокачественных опухолей (аденокарцинома) толстой кишки, полученный от пациентов Юга России (ЮФО России, Краснодарский край). Все пациенты проходили плановое лечение в Клиническом онкологическом диспансере № 1 Министерства здравоохранения Краснодарского края и в Краевой клинической больнице № 2 (г. Краснодар). ДНК для исследования экстрагировалась из FFPE-блоков с использованием набора реагентов «ДНК-Ткань-Ф» («ТестГен», Россия). Образцы ДНК проходили первичный скрининг на предмет наличия/отсутствия семи активирующих соматических мутаций в 12 и 13 кодонах 2 экзона гена KRAS с использованием набора реактивов «Real-Time-PCR-KRAS-7M» («Биолинк», Новосибирск), имеющего 5% уровень чувствительности с использованием системы детекции «Real-Time PCR CFX96 Touch™» (Bio-Rad, США). По результатам предварительного тестирования рутинными клиническими методами RT-PCR образцы были разделены на 2 группы: группу KRAS WT (образцы, не имеющие активирующих мутаций в гене KRAS для 5%-ного уровня чувствительности) и группу образцов KRAS MT (образцы, имеющие активирующие мутации в гене KRAS для 5%-ного уровня чувствительности). Исследование проведено с соблюдением «Этических принципов проведения научных медицинских исследований с участием человека» и в соответствии с «Правилами клинической практики в Российской Федерации».
Высокочувствительный ddPCR скрининг наличия/отсутствия 7 активирующих соматических мутаций (G12A, G12C, G12D, G12R, G12S, G12V и G13D) во втором экзоне гена KRAS и мутаций V600 (V600E, V600K и V600R) в гене BRAF проводили методом Digital Droplet PCR (ddPCR) с использованием наборов «ddPCR KRAS Screening Multiplex Kit» (Bio-Rad, США) и BRAF V600 Screening Kit (Bio-Rad, США) соответственно и QX200™ Droplet Digital™ PCR System (Bio-Rad, США). Статистическую обработку результатов проводили с использованием пакета прикладных программ Microsoft Excel 2013 (Microsoft Corporation, США) и Statistica 10.0 (StatSoft Inc., США).
Результаты исследования и обсуждение
Активирующие соматические мутации в гене KRAS регистрируются в 9-30% всех случаев онкологических заболеваний. Наиболее распространены мутации в гене KRAS (86%), затем NRAS (11%) и HRAS (3%) [9]. От 8 до 12% случаев метастатических КРР проявляют наличие активирующих мутаций в гене BRAF [10].

Рис. 1. Представленность групп опухолей толстого кишечника с различным содержанием KRAS MT и BRAF MT (от 40 до 0%) от всего объёма исследованной выборки
На рисунке 1 представлены результаты нашего исследования количественной ранжированной оценки представленности групп опухолей, классифицированных по количественному содержанию в них активирующих соматических мутаций в генах KRAS и BRAF от 40 до 0% (процент содержания MT по отношению к событиям регистрации WT+MT вариантов гена). Обращает на себя внимание факт почти значительной представленности (от 9 до 19% от всего количества опухолей) групп мутаций в гене KRAS в диапазоне от 40 до 19%: именно в этом количественном диапазоне активирующие соматические мутации в гене KRAS могут быть зарегистрировавны подавляющим большинством рутинных методов (RT-PCR, секвенирование по Сэнгеру, HRM). В диапазоне от 1 до 9,9% содержания активирующих мутаций в гене KRAS мы не зарегистрировали ни одного опухолевого образца (0%, рисунок 1). В диапазон относительного содержания активирующих соматических мутаций в гене KRAS от 0,9 до 0,1% вошли 47% исследованных нами образцов. Нужно отметить, что данный диапазон чувствительности не детектируется рутинными методами RT-PCR и методом секвенирования по Сэнгеру. В соответствии с нашими результатами, рутинно используемые методы не позволяют обнаружить приблизительно 50% от всех возникающих в гене KRAS активирующих соматических мутаций. С точки зрения клональной теории возникновения и развития онкологических заболеваний, это позволяет нам предположить, что опухоли, содержащие от 1 до 0,1% KRAS MT, в условиях применения таргетной терапии будут прогрессировать и приобретать устойчивость к таргетной терапии благодаря селективному преимуществу клонов с KRAS MT по сравнению с клонами клеток, имеющими WTKRAS. В количественном диапазоне 0,09-0% было зарегистрировано только 6% событий. Мы считаем, что этот диапазон можно отнести к уровню отсутствия KRAS MT в силу статистической и экспериментальной погрешности. Таким образом, 94% образцов тканей РТК пациентов имели соматические активирующие мутации в гене KRAS в количественном диапазоне от 40 до 0,1%. Мы объясняем такие различия с данными, полученными традиционными методами при детекции аналогичных показателей методами RT-PCR (приблизительно 50%), существенными (50-кратными) различиями в чувствительности рутинных методов RT-PCR (5% уровень чувствительности) по сравнению с ddPCR (0,1%).
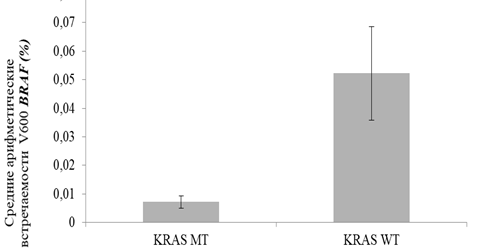
Рис. 2. Процент встречаемости мутаций V600 в 15 экзоне гена BRAF в двух группах пациентов с раком толстой кишки: с наличием активирующих соматических мутаций в 12 и 13 кодонах гена KRAS для 5%-ного уровня детекции (KRAS MT) и без мутаций (KRAS WT)
Детекция мутаций V600 проводилась с использованием высокочувствительного метода ddPCR.
При скрининге активирующих соматических мутаций V600 в гене BRAF методом ddPCR в образцах первичных опухолей РТК с использованием метода ddPCR, нами были детектированы мутации с содержанием 0,9-0,1% в 31% образцов, а в 69% образцов опухолей мутации обнаружены не были (рисунок 1). Рутинные методы детекции не позволяют обнаружить активирующие соматические мутации в гене BRAF с содержанием менее 5% (от 0,9 до 0,1%), но прогностическая важность наличия/отсутствия мутаций в гене BRAF не подлежит сомнению. Поэтому клинические группы пациентов с РТК, несущие активирующие соматические мутации V600 в гене BRAF с титром 0,9-0,1% (ниже уровня стандартной детекции методами RT-PCR и секвенирования по Сэнгеру), должны быть дополнительно исследованы на предмет эффективности лечения таргетными препаратами и вероятность неблагоприятного исхода заболевания.
В следующей части нашего исследования был проведен анализ возможных различий по показателю процентов содержания активирующих соматических мутаций V600 в гене BRAF с использованием высокочувствительного метода ddPCR в двух группах пациентов с РТК: в группе с наличием активирующих соматических мутаций в гене KRAS с титром более 5% (KRAS MT) и в группе с отсутствием (по данным RT-PCR) активирующих соматических мутаций в гене KRAS на уровне менее 5% (KRAS WT).
На рисунке 2 представлены результаты наших количественых экспериментальных данных (ddPCR), характеризующие показатели средних арифметических значений процентного содержания мутаций V600 (по отношению к общему количеству зарегистрированных событий) в тканях пациентов, имеющих показатели содержания MT KRAS более (KRAS MT) и менее (KRAS WT) 5%. Приведенные на рисунке 2 данные отражают картину 5-кратного преобладания проявления мутаций V600 в гене BRAF в группе пациентов с диким типом гена KRAS (KRAS WT, средняя арифметическая для V600 0,05% по отношению к показателю дикого типа гена BRAF) по сравнению с аналогичными показателями для группы пациентов с мутантным типом гена KRAS (KRAS MT, средняя арифметическая для V600 0,01% по отношению к показателю дикого типа гена BRAF). Продемонстрированные нами различия носят статистически достоверный характер для уровня значимости p с поправкой Bonferoni-Sidak= 0,543%. Также данные различия между показателями этих клинических групп носят статистически достоверный характер при использовании параметра Anova для уровня значимости p=0.743%. В этом случае заслуживает внимания факт того, что в группе пациентов KRAS WT показатели вариабельности данных проявления V600 кратно превышают аналогичные показатели для группы пациентов KRAS MT (рисунок 2). Это может объясняться тем, что в тканях пациентов группы KRAS WT создаются более благоприятные условия для возникновения и селекции клонов клеток с активирующими мутациями в гене BRAF.
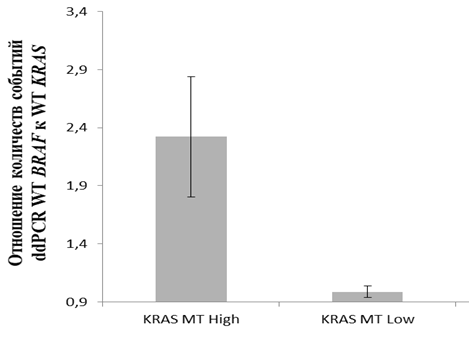
Рис. 3. Отношение количеств событий детекции BRAF WT к количеству событий детекции KRAS WT в разных клинических группах пациентов (KRAS более 5% - KRAS MT High и KRAS менее 5% - KRAS MT Low.), полученное методом ddPCR
Как следует из данных, приведенных на рисунке 3, у группы пациентов KRAS MT с аденокарциномой толстого кишечника, имеющих высокий уровень проявления активирующих мутаций в гене KRAS (более 5%), среднее значение отношений количества зарегистрированных событий в генах BRAF WT/KRAS WT более чем в 2 раза превышает аналогичный показатель для группы пациентов с низким уровнем проявления активирующих мутаций в гене KRAS (менее 5%). Данные различия средних статистически достоверны для уровня p=0,121% (Критерий Манна-Уитни с учетом поправки Бонферрони). Эти данные позволяют нам предположить, что в группе пациентов KRAS MT в процессе малигнизации тканей толстого кишечника происходит повышение относительной копийности локуса BRAF по сравнению с аналогичным показателем для локуса KRAS. Это демонстрирует нам, что в тканях опухолей с высокими показателями титра MT KRAS происходит адаптивное увеличение относительной копийности гена BRAF, что также не может не сказываться на работе сигнального пути MAPK/ERK.
В работе [11] была исследована 2121 колоректальная опухоль на предмет наличия мутаций в кодонах 12 и 13 гена KRAS. Подмножество этих образцов, состоящее из 513 образцов дикого типа для кодонов KRAS 12 и 13, было проверено на наличие мутаций в кодонах 61 и 146 гена KRAS, кодоне 600 BRAF и кодонах 12, 13 и 61 гена NRAS методом пиросеквенирования. Мутации в кодонах 12 или 13 гена KRAS были выявлены в 42,4%. Из 513 образцов дикого типа, протестированных на дополнительные мутации, 78 образцов были мутантными для гена BRAF (15,2%), 19 (3,7%) - для 61 кодона гена KRAS, 17 (3,3%) - для 146 кодона гена KRAS и 26 (5,1%) - для гена NRAS. В общей сложности 140/513 (27,3%) опухолей дикого типа для кодонов 12 и 13 KRAS содержали мутацию в другом из генов сигнального пути RAS. Поэтому мутационное тестирование этих кодонов может быть полезным для выявления значительной части пациентов, которые также могут быть устойчивыми к анти-EGFR терапии. Результаты нашего комплексного исследования не противоречат основным выводам этой работы, а также существенно расширяют её благодаря использованию высокочувствительного метода детекции (ddPCR).
Увеличение копийности гена BRAF - один из основных механизмов приобретенной устойчивости к терапии на основе BRAF-ингибиторов, поддерживающей активацию сигнального пути MAPK, а, следовательно, и пролиферацию опухолевых клеток. Поэтому амплификация гена BRAF часто служит маркером высокой вероятности рецидивирования опухолевого процесса. Более высокое количество копий гена BRAF было обнаружено в образцах опухолей у пациентов с прогрессированием заболевания по сравнению с исходными биопсиями. Также сообщалось об увеличении числа копий гена BRAF как в образцах перед лечением у пациентов с метастатической меланомой, которые не реагировали на терапию, так и в линиях клеток, устойчивых к ингибитору MAPK (MAPKi). Таким образом, амплификация гена BRAF может быть приобретенным механизмом устойчивости, который развивается de novo в опухолевых клетках для преодоления ингибирования BRAF, или же он может также играть роль внутреннего механизма малигнизации опухоли до воздействия MAPKi [12].
Выводы
- Колоректальные аденокарциномы при использовании высокочувствительного метода детекции соматических мутаций (ddPCR) в 94% случаев содержали активирующие соматические мутации в гене KRAS, и это значение было почти в 2 раза больше величины (57%), полученной для тех же образцов с применением стандартного метода RT-PCR.
- 31% колоректальных аденокарцином в нашем исследовании являлись носителями активирующих соматических мутаций V600 в гене BRAF. Для 5% уровня детекции этот показатель составил 0%. В 69% остальных образцов опухолей активирующие соматические мутации V600 обнаружены не были даже методом ddPCR для уровня чувствительности 0,1%.
- Содержание активирующих соматических мутаций V600 в группе пациентов с KRAS MT было в 5 раз меньше аналогичного показателя для группы пациентов KRAS WT, что может свидетельствовать о разных механизмах малигнизации клеток для этих групп пациентов.
- Копийность гена BRAF в группе пациентов с KRAS MT High более чем в 2 раза превышала копийность гена KRAS в группе пациентов с KRAS MT Low. В сочетании с предыдущим выводом это свидетельствует о том, что малигнизация клеток толстой кишки происходит комплексно: как через возникновение активирующих соматических мутаций в генах сигнального пути EGFR, так и через изменение их копийности.
Полученные в настоящем исследовании данные представляют интерес при оптимизации диагностических исследований и таргетной терапии пациентов со злокачественными опухолями толстой кишки.



