За последние десять лет распространенность остеоартроза (ОА) в Российской Федерации увеличилась в среднем в 2,7 раза и составила около 13% среди заболеваний костно-мышечной системы. Этому есть несколько объяснений. Одним из таких факторов является старение населения: признаки ОА при рентгенологическом исследовании обнаруживают у половины людей в возрасте 55 лет, а среди лиц старше 75 лет - в 80% случаев [1].
Патогенез ОА характеризуется развитием метаболических нарушений и воспаления в клетках хряща, синовиальной оболочки сустава, а также остеоцитах. Эти процессы способствуют деструкции субхондральной области с последующей гибелью хондроцитов. Медиаторы воспаления при ОА активно вырабатываются адипоцитами при ожирении, повышающем нагрузку на суставы, а также при наличии дислипидемии, повышении уровня глюкозы и мочевой кислоты, артериальной гипертензии (АГ) и гипоксии. Этим объясняется тот факт, что лечение боли при ОА будет эффективным только при достижении целевых показателей мочевой кислоты, холестерина, АД, глюкозы. При этом терапия должна включать не только медикаментозные, но и нефармакологические методы, а в ряде случаев требуется хирургическая коррекция [2].
В 2014 году Международное общество по изучению ОА (Osteoarthritis Research Society International) предложило следующие критерии для классификации ОА: по числу пораженных суставов принято выделять локальную и генерализованную формы заболевания. Также по наличию сопутствующей патологии различают ОА с коморбидностью или без неё. Наличие умеренного коморбидного риска характерно для пожилых пациентов, лиц с избыточной массой тела, заболеваниями органов ЖКТ, наличием АГ или сахарного диабета 2 типа. Хроническая почечная недостаточность, инфаркт миокарда и/или инсульт, кровотечения из дефектов слизистой оболочки ЖКТ являются признаками высокого коморбидного риска [3].
Физические упражнения при ОА необходимы, так как способствуют укреплению мышц и увеличению объема движений как при поражении коленных суставов (уровень доказательности А), так и тазобедренных (уровень доказательности С) [2].
Физическая нагрузка повышает толерантность к боли: повышает уровень β-эндорфинов в плазме, усиливает нисходящую серотонинергическую и норадренергическую ингибицию, активирует крупнокалиберные сенсорные волокна, закрывает «ворота боли», синтезирует противовоспалительные цитокины (миокины) [4].
При подборе терапии обязательно необходимо учитывать наличие противопоказаний для занятий лечебной физкультурой у больных ОА. Абсолютными противопоказаниями являются рефрактерная к лечению аритмия, нестабильная стенокардия, а также АВ-блокада 3 степени, относительными – наличие пороков сердца, кардиомиопатия, отсутствие адекватного контроля АГ [2].
Одним из видов физической активности при заболеваниях суставов является скандинавская ходьба [5]. Это наиболее простой и доступный способ тренировки, не требующий высокого уровня начальной физической подготовки. При этом скандинавская ходьба задействует почти все мышцы (до 90%), что обеспечивает значительную энергетическую емкость занятий по сравнению с обычной ходьбой [6]. Это позволяет достичь снижения веса при наличии избыточной массы тела, а также позитивно влияет на сократительную способность миокарда и способствует увеличению жизненной емкости легких (ЖЕЛ). Скандинавская ходьба, помимо укрепления четырехглавой мышцы бедра, вовлекает в работу мышцы плечевого пояса и рук, благодаря чему наблюдается увеличение расхода энергии в среднем на 20% при умеренном скоростном режиме [7].
Цель исследования: оценить в открытом сравнительном контролируемом рандомизированном 12-месячном исследовании влияние скандинавской ходьбы на выраженность болевого синдрома и качество жизни больных ОА.
Материал и методы исследования. Методом простой случайной выборки в исследование были включены 120 больных (90 женщин и 30 мужчин) в возрасте от 51 до 70 лет с подтвержденным рентгенологическими методами диагнозом ОА. Пациенты были разделены на 2 группы по 60 человек в каждой, сопоставимые по половозрастным характеристикам и длительности заболевания. Все пациенты в письменном виде давали добровольное информированное согласие на участие в исследовании. Критериями включения являлось наличие генерализованного ОА с преимущественным поражением коленных, плечевых и тазобедренных суставов, II рентгенологическая стадия и I степень функциональной недостаточности суставов. Критерии исключения: развитие анкилозов, возраст старше 70 лет, отказ от участия в исследовании.
В обеих группах, помимо рутинного клинического обследования (опрос, осмотр, физикальные методы исследования, ОАК, ОАМ, ЭКГ, рентгенография суставов), определяли уровень С-реактивного белка (СРБ), липидный спектр плазмы крови, индекс массы тела (ИМТ), а также оценивали уровень тревожности по Спилбергеру-Ханину и показатели качества жизни (КЖ) с помощью опросника SF- 36.
Статистический анализ результатов проводился с использованием пакета программ SPSS 21.0. Для количественных данных определяли среднее арифметическое и стандартное отклонение (M±SD), качественные данные представлены частотами (%). Значимость различий между группами с нормальным распределением определяли с помощью t-критерия для независимых групп. В группах с распределением, отличным от нормального, использовали U-критерий Манна-Уитни. Для определения силы корреляционной связи между признаками вычисляли критерий Пирсона. Для всех видов анализа различия считали достоверными при р< 0,05.
Исследуемые группы были сопоставимы по половозрастным характеристикам и длительности заболевания (таблица 1).
Таблица 1
Характеристика исследуемых групп на момент включения в исследование
|
Показатели |
1 группа (n=60) |
2 группа (n=60) |
|
Возраст, лет (M±SD) |
57,4±7,3 |
56,6±8,7 |
|
Длительность заболевания: менее 5 лет от 6 до 10 лет более 10 лет |
46,7% 36,7% 16,6% |
48,4% 31,5% 20,1% |
Из числа сопутствующих заболеваний наиболее часто встречались АГ, метаболический синдром, ишемическая болезнь сердца (ИБС) и сахарный диабет (СД). В первой группе ИБС была у 4 больных (0,6%), во второй группе – у 5 человек (0,8%); АГ у 38 человек (63,3%) и 39 (65,0%) соответственно, хроническая сердечная недостаточность (ХСН) ФК 2 по NYHA выявлена у 24 больных (40,1%) первой группы и 23 человек (38,3%) второй группы, атеросклероз периферических артерий у 8 пациентов (13,3%) первой группы и у 6 больных (10,1%) второй группы.
Пациенты обеих групп получали медикаментозное лечение: диацереин 100 мг/сутки курсами по 4 месяца с трехмесячными перерывами в сочетании с хондроитина сульфатом 1000 мг/сутки курсами по 6 месяцев с двухмесячными перерывами. Все больные получили 2 курса терапии.
Пациентам 2-й группы к лекарственной терапии была добавлена скандинавская ходьба. Главным условием ее была регулярность занятий и систематическое увеличение нагрузки. Скандинавская ходьба рекомендовалась после приема лекарственных препаратов под контролем пульса (увеличение ЧСС не более чем на 20-25 в минуту) и частоты дыхательных движений (увеличение ЧДД не более чем на 10-12 в минуту). Также физическая нагрузка не должна сопровождаться усилением боли и выраженным утомлением. Нагрузка считалась правильной, если после скандинавской ходьбы пациент чувствовал прилив энергии, бодрости, уменьшение боли и скованности в суставах и мышцах.
Результаты исследования и их обсуждение. Основными жалобами, которые предъявляли пациенты с ОА, были «стартовые» боли в суставах, быстро проходящая утренняя скованность, тугоподвижность и уменьшение объема движений, периодическое заклинивание, а также деформация суставов и изменение походки и осанки (таблица 2).
Таблица 2
Симптомы ОА, характерные для пациентов исследуемых групп, %
|
Симптомы |
1 группа (n=60) |
2 группа (n=60) |
|
Боли в суставах |
89,6±6,4 |
90,4±7,2 |
|
Утренняя скованность |
56,8±4,8 |
54,2±3,9 |
|
Уменьшение объема движений в суставах |
48,3±3,6 |
49,6±4,0 |
|
Заклинивание |
39,3±5,2 |
37,5±3,9 |
|
Деформация суставов |
35,4±3,2 |
36,2±3,8 |
|
Изменение походки, хромота |
30,6±2,9 |
28,9±2,6 |
Исходная выраженность болевого синдрома по ВАШ в первой группе составила 41,0±2,4 мм, а во второй - 42,1±2,7 мм. Уровень СРБ в первой группе был 5,3±1,6 ммоль/л; во второй – 4,8±1,3 ммоль/л.
ИМТ у пациентов первой группы был 36,49 ± 1,01 кг/кв. м, второй группы - 35,89 ±1,2 кг/кв. м. У подавляющего большинства больных (89%) отмечались нарушения липидного спектра по типу гиперхолестеринемии III типа по Фредриксону.
По результатам анализа КЖ в исследуемых группах выявлено снижение физического и психологического компонентов здоровья (таблица 3). Больше всего страдали показатели физического функционирования (PF), ролевого физического функционирования (RF), боли (BP) и ролевого эмоционального функционирования (RE). В меньшей степени снижались показатели по шкалам общего здоровья (GH), жизнеспособности (VT), социального функционирования (SF) и психологического здоровья (MH). При этом 49 чел. (81,7%) в первой группе и 52 чел. (86,7%) во второй группе имели среднюю и высокую тревожность по шкале Спилбергера-Ханина.
Таблица 3
Динамика показателей качества жизни в исследуемых группах
|
Показатели |
До начала исследования |
Через 6 месяцев |
Через 12 месяцев |
|||
|
1 группа (n=60) |
2 группа (n=60) |
1 группа (n=60) |
2 группа (n=60) |
1 группа (n=60) |
2 группа (n=60) |
|
|
PF |
41,4±5,1 |
40,4±4,7 |
44,8±6,1 |
50,4±5,4* |
48,4±6,0*# |
57,9±7,5*# |
|
RP |
41,1±4,4 |
44,1±5,1 |
48,1±5,5 |
47,4±5,1 |
50,4±5,6* |
54,4±4,4* |
|
BP |
44,7±4,0 |
45,1±4,8 |
50,4±5,1 |
56,7±6,0* |
54,4±6,6*# |
64,1±5,1*# |
|
GH |
67,1±4,6 |
64,1±5,4 |
74,1±4,8 |
71,4±5,4 |
74,4±5,1 |
74,1±5,1* |
|
VT |
64,4±5,1 |
64,4±6,1 |
67,4±6,1 |
68,7±6,0 |
70,4±6,7*# |
78,9±6,0*# |
|
SF |
64,5±6,8 |
60,1±5,7 |
64,9±6,5 |
70,4±8,1 |
66,1±5,8*# |
74,4±6,0*# |
|
RE |
58,4±6,4 |
58,1±5,7 |
61,0±5,4 |
64,8±6,1 |
64,1±6,4*# |
68,8±5,7*# |
|
MH |
65,7±4,4 |
66,4±5,0 |
68,1±5,6 |
74,8±4,9* |
71,5±6,5*# |
79,1±7,0*# |
|
Суммарный показатель физического здоровья |
54,7±4,8 |
55,1±5,0 |
57,1±6,0 |
61,1±7,1 |
59,1±6,9# |
65,1±5,8*# |
|
Суммарный показатель психического здоровья |
60,1±6,1 |
61,0±5,9 |
64,4±5,7 |
66,7±7,5 |
65,4±5,8 |
69,4±6,4* |
* - значимость различий в группах между показателями до начала исследования и через 6 и 12 мес. при р<0,05 (критерий Вилкоксона);
# - значимость различий между группами при р<0,05 (U-критерий Манна-Уитни).
Результаты корреляционного анализа свидетельствуют о наличии статистически значимой отрицательной связи между показателями КЖ и уровнем тревожности: общее восприятие здоровья (GH) r = -0,31; p<0,05, жизнеспособность (VT) r = -0,38; р<0,05, эмоциональное функционирование (RE) r = -0,43; p< 0,01, социальная активность (SF) r = -0,39; p<0,05, психическое здоровье (МН) r = -0,48; p< 0,01.
К концу лечения выраженность болевого синдрома по ВАШ уменьшилась в обеих группах наблюдения: в первой группе на 52,1% и составила 20,2±1,8 мм, а во второй – на 75% и составила 10,5±1,7 мм (p<0,001). У всех наблюдаемых наблюдалось повышение КЖ в отношении как физического, так и психологического компонентов здоровья (таблица 3).
Одновременно у 64,6% лиц первой группы и 76,3% второй группы наблюдалось снижение уровня тревожности по опроснику Спилбергера-Ханина. До начала лечения в первой группе низкий уровень тревожности (до 30 баллов) был выявлен у 6,8% пациентов, средняя степень тревожности (31-45 баллов) – в 16,4% случаев, а высокий уровень (46 баллов и более) – у 76,8%. У пациентов второй группы аналогичные показатели составили 5,9%, 18,6% и 75,5% соответственно. Через 12 мес. после лечения количество пациентов с низким уровнем тревожности в первой группе увеличилось до 11,5%, средняя степень определялась в 20,6% случаев, а число лиц с высоким уровнем тревожности снизилось до 76,9% (p<0,05). Во второй группе низкий уровень тревожности повысился до 15,8% по сравнению с исходным, также увеличилось количество пациентов со средним уровнем тревожности (26,4%; p<0,05) за счет уменьшения числа лиц с высокой тревожностью (57,8%; p<0,01). При анализе динамики состояния пациентов отмечено улучшение у 55,2% больных первой группы и значительное улучшение у 38,1%, во второй группе аналогичные показатели составили 60,1% и 37,2% соответственно (рисунок).
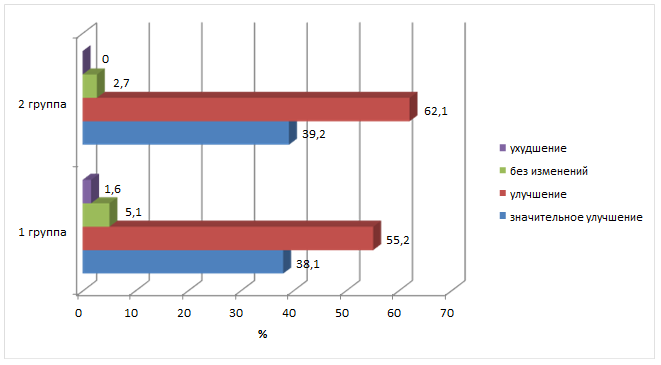
Изменение состояния пациентов через 12 мес. после начала лечения (в % от количества пациентов в группе)
При сравнительной оценке выявлено преимущество терапии симптоматическими препаратами медленного действия с добавлением скандинавской ходьбы как по влиянию на выраженность болевого синдрома, так и по частоте уменьшения других симптомов (утомляемости, одышки, болей в сердце и головных болей).
Качество жизни пациентов с ОА страдает из-за наличия болевого синдрома, развития тугоподвижности и функциональной недостаточности суставов, а также формирования деформации. Все это сопровождается снижением общей активности больных. В литературе имеются данные о преимуществе терапии хондроитина сульфатом и комбинации хондроитина сульфата с глюкозамина сульфатом в сравнении с нестероидными противовоспалительными препаратами или плацебо в отношении влияния на КЖ пациентов с ОА. В нашем исследовании также отмечено повышение показателей КЖ при применении симптоматических препаратов медленного действия. А при добавлении к медикаментозной терапии физической нагрузки в виде скандинавской ходьбы нами отмечена наиболее благоприятная положительная динамика клинических проявлений ОА (уменьшение выраженности болевого синдрома, улучшение качества жизни пациентов). Это может объясняться тем, что скандинавская ходьба является естественным стимулятором защитных функций организма и способствует повышению адаптационных резервов. Стимулирующее действие данного вида физической нагрузки проявляется в повышении тонуса ЦНС и активизации метаболизма. При выполнении мышечной работы в кровь выделяются гормоны, стимулирующие работу сердца, а их метаболиты, образующиеся в мышцах, расширяют артериолы. Кроме того, физические упражнения повышают эффективность лекарственных средств. Такое сочетание нервных и гуморальных влияний обеспечивает благоприятную реакцию пациента на различные виды физических нагрузок.
Выводы. Таким образом, применение симптоматических препаратов медленного действия (диацереина и хондроитина сульфата) улучшает качество жизни пациентов с ОА по шкалам физического здоровья, а дополнительное назначение скандинавской ходьбы дает выраженное положительное влияние на показатели психологического здоровья.



