Проблема профилактики и лечения ИБС в России продолжает оставаться одной из главнейших, наряду с онкологическими заболеваниями и острыми нарушениями мозгового кровообращения. По данным Росстата, в 2018 году зарегистрировано 841 915 случаев летальных исходов от заболеваний системы кровообращения, среди которых более 53,3% приходится на ИБС [1]. Сложности на пути решения снижения инвалидизации и смертности больных ИБС за счет острого коронарного синдрома и внезапной сердечной смерти связаны с атеротромбозом при неэффективности гиполипидемической терапии. Известные сегодня классы гиполипидемических препаратов, их комбинации, используемые в практике и отраженные в клинических рекомендациях, все же не являются абсолютно эффективными [2].
Доказано отсутствие лекарственного ответа на фармакологическую коррекцию гиперлипидемии (ГЛП) у каждого пятого пациента [2], что объясняется мультифакториальностью ИБС. Связь ишемической болезни с генетическими факторами и факторами окружающей среды сомнений не вызывает [3; 4]. В ряде отечественных и зарубежных эпидемиологических исследований отмечены факты дестабилизации липидного профиля и течения ИБС у больных в различные сезоны года при подъеме вирусной заболеваемости [5; 6]. Так, в осенне-весенний периоды увеличивается количество амбулаторных обращений к кардиологу и госпитализаций больных ИБС в кардиологические отделения после перенесенной ОРВИ, а также – в инфекционные стационары при тяжелом течении инфекционного процесса [3-5].
Таким образом, фармакологическая коррекция нарушений липидного обмена у больных ИБС в сочетании с ОРВИ меняется по сравнению с существующими стандартами по причине отсутствия или снижения лекарственного ответа. Неэффективность гиполипидемической терапии связана с резкими изменениями липидного обмена в связи с прогрессированием атеросклероза. Согласно иммунно-воспалительной теории атерогенеза, выдвинутой еще в середине XIX века, воспаление играет роль не только в процессах формирования атеросклеротической бляшки, но и в нарушении ее стабильности с последующим атеротромбозом. Наличие воспалительных процессов в бляшке подтверждено биохимическими признаками воспаления с определением цитокинов, острофазовых белков, молекул адгезии, нейтрофилов [5].
Активация в бляшке хронического воспаления происходит с участием провоспалительных цитокинов (ФНО-а, IL-1β, IL-6) при присоединении острого инфекционного процесса. Обнаруживаемые в бляшке вирусы гриппа, герпеса, хламидии являются индукторами активизации воспалительных процессов при ОРВИ [3; 4].
При остротекущем воспалении развивается дисбаланс про- и противовоспалительных цитокинов, что отражается на процессах течения атеросклероза и состоянии липидного профиля [6]. Таким образом, маркеры воспаления имеют не только прогностическое диагностическое значение, но и являются мишенью для изучения при развитии лекарственного ответа на статинотерапию.
Цель исследования: изучить особенности фармакологического ответа больных ИБС в сочетании с ОРВИ на статинотерапию с учетом полиморфизма генов интерлейкинов.
Материал и методы исследования
Было исследовано 200 больных ИБС, среди которых 120 перенесли ОРВИ.
Критериями включения служили: мужской и женский пол (в постменопаузе), возраст от 41 до 60 лет, ИБС, стабильная стенокардия напряжения I-II функционального класса (ФК), ОРВИ, изолированная или сочетанная гиперхолестеринемия (ГХС) (пациенты с уровнем ХС > 5,5 ммоль/л, ТГ> 1,7 ммоль/л) [7], отсутствие противопоказаний к назначению статинов, проведение фармакотерапии статинами IV поколения в стартовой дозе 10 мг/сут. до включения в исследование, информированное согласие пациента.
Критериями исключении стали: индивидуальная непереносимость розувастатина; побочные эффекты от проводимой терапии (повышение уровня печеночных трансаминаз более чем в 3 раза); отказ пациента от проводимого лечения; а также наличие коморбидной патологии, влияющей на параметры липидного обмена.
При верификации ГХС основывались на критериях включения, наличии повышенного уровня липидных фракций. Пациенты с вторичными нарушениями липидного обмена в исследование не включались.
Диагноз ИБС и ФК стабильной стенокардии подтвержден клинической картиной и результатами инструментального исследования на амбулаторном этапе наблюдения.
Исследование проведено простым проспективным методом.
На I визите проводился скрининг и включение в исследование больных, страдающих ИБС, удовлетворяющих критериям включения. Фармакотерапия гиперлипидемии (ГЛП) осуществлялась розувастатином 10 мг/сут. согласно рекомендациям [7].
При каждом визите определяли уровень ХС ЛНП сыворотки крови энзиматическим калориметрическим методом на анализаторе фирмы «Виталаб Флексор Е» наборами «Analyticon».
Верификация инфекционного заболевания осуществлялась по клинической картине, вирусологическим методом путем проведения полимеразно-цепной реакции (ПЦР) мазков из носоглотки.
Фармакотерапия инфекционного заболевания проводилась согласно рекомендациям [8] противовирусными (умифеновир – 0,2 г 4 раза в сут.), а при бактериальных осложнениях – антибиотиками (макролиды – азитромицин – 0,5 г 1 раз в сут. или цефалоспорины III поколения – цефтриаксон – 1,0 г 2 раза в сут. в/м). В качестве симптоматического лечения использовались жаропонижающие (анилиды – парацетамол 0,5 г.). Так, цефтриаксон назначался в 40% случаев, азитромицин - в 23% случаев, умифеновир – в 100% случаев.
Геномную дезоксирибонуклеиновую кислоту (ДНК) выделяли из замороженной (-20 °С) венозной крови методом фенольно-хлороформной экстракции. Генотипирование полиморфизмов –511C>T гена IL-1β, –174G>C гена IL-6, –589C>T гена IL-4, –1082G>А гена IL-10 проводилось методом ПЦР на амплификаторе CFX96 Bio-Rad Laboratories (США) по методике, разработанной на кафедре биологии, медицинской генетики и экологии ФГБОУ ВО «КГМУ» Минздрава России [3].
Статистическую обработку данных проводили в программе Microsoft Excel Office 2007, Statistica 10. Характер распределения количественных признаков и нормальность оценивали с помощью критерия Колмогорова-Смирнова. Статистически значимым показателем считали значение уровня p<0,05. Для выявления силы и направления связи между исследуемыми признаками пользовались корреляционным анализом с расчетом коэффициента корреляции по Пирсону (r).
Результаты исследования и их обсуждение
У больных ИБС при включении в исследование гиполипидемический эффект розувастатина (10 мг/сут.) реализовался у 55,7% больных, среди которых 30,1% пациентов – с изолированной и 25,6% – с сочетанной ГХС.
Через 4 недели (II визит) при госпитализации 120 больных в Областную клиническую инфекционную больницу по поводу ОРВИ было отмечено снижение возможности достижения целевого уровня ХС ЛНП (1,8 ммоль/л) [1] при прежней фармакотерапии розувастатином 10 мг/сут.
На этом визите целевого уровня ХС ЛНП смогли достичь 37,5% пациентов (23,2% – с изолированной и 14,3% – с сочетанной ГХС).
Данные о дестабилизации течения атеросклероза способствовали изменению проводимой терапии ГЛП с титрацией дозы розувастатина. При этом клинических признаков дестабилизации ИБС зарегистрировано не было, что подтверждено регистрацией ЭКГ в динамике.
После II визита больным осуществлялась фармакологическая коррекция ГЛП как розувастатином 10 мг/сут., так и розувастатином 20 мг/сут. для увеличения числа больных, достигших целевого уровня ХС ЛНП (рис. 1).
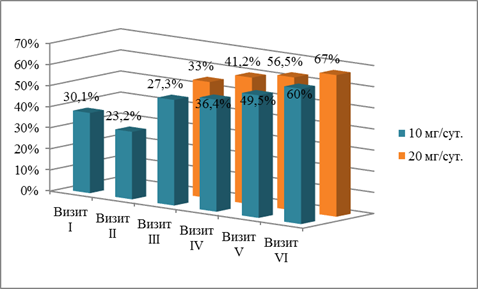
Рис. 1. Процент пациентов c ИБС с изолированной ГХС + ОРВИ, достигших целевого уровня ХС ЛНП на фоне терапии розувастатином при различных дозовых режимах
Оценку достижения целевого уровня ХС ЛНП проводили через 7 (III визит), 14 (IV визит), 28 дней (V визит) и 3 месяца (VI визит) от момента заболевания ОРВИ.
На III визите у больных ИБС с изолированной ГХС показано достижение целевого уровня ХС ЛНП в 27,3% случаев при приеме 10 мг розувастатина.
При дальнейшем наблюдении было отмечено достижение целевого холестерина у 36,4% (IV визит), у 49,5% (V визит), у 60% больных (VI визит) при фармакотерапии ГЛП розувастатином 10 мг/сут. Соответственно, титрование дозы до 20 мг/сут. привело к достижению целевого уровня ХС ЛНП у 33% (III визит), 41,2% (IV визит), 56,5% (V визит) 67% больных (VI визит).
Одновременное наблюдение за достижением целевого уровня ХС ЛНП у больных ИБС с сочетанной ГХС показало возможность достижения при дозовом режиме 10 мг/сут. у 18,2% (III визит), 26,8% (IV визит), 38,7% (V визит) и 57,5% пациентов (VI визит) (рис. 2).
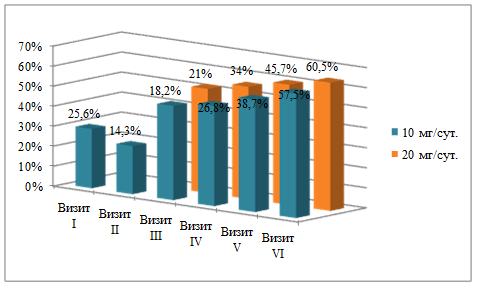
Рис. 2. Процент пациентов c ИБС с сочетанной ГХС + ОРВИ, достигших целевого уровня ХС ЛНП на фоне терапии розувастатином в различных дозовых режимах
После титрации дозы розувастатина до 20 мг/сут. удалось достичь целевого уровня ХС ЛНП у 21% (III визит), 34% (IV визит), 45,7% (V визит), 60,5% исследуемых пациентов (VI визит).
Так, титрация дозового режима розувастатина до 20 мг способствовала усилению его гиполипидемического эффекта.
Для оценки влияния цитокинов на прогрессирование атеросклероза в аспекте снижения выраженности лекарственного ответа были изучены особенности функционирования системы цитокинов на генетическом уровне.
В результате генотипирования полиморфизмов генов IL-1β, IL-6, IL-4, IL-10 были получены следующие генотипы: IL-1β –511C>T (–511CC, –511CТ, –511ТТ), IL-6 –174G>C (–174GG, –174GC, –174CC), IL-4 –589C>T (–589СС, –589СТ, –589ТТ), IL-10 –1082G>A (–1082AA, –1082AG, –1082GG). Распределение частот генотипов соответствовало закону Харди – Вайнберга.
Наличие связей между определенными генотипами про- и противовоспалительных цитокинов и изменениями липидного профиля больных при оценке лекарственного ответа розувастатина описывалось корреляционными взаимодействиями.
Влияние гетерозиготного генотипа –511СТ гена IL-1β на уровень ХС ЛНП показало прямую слабую связь (r=0,46, p<0,05). У носителей этого генотипа отмечались наиболее высокие значения ХС ЛНП – 2,54 ммоль/л (p<0,05).
У носителей генотипа –174GG гена IL-6, уровень ХС ЛНП превышал таковой в сравнении с другими генотипами IL-6 – 2,51 ммоль/л (r=0,6, p<0,05).
Доказано, что наличие полиморфизма –589 C/T гена IL-4, находящегося в промоторной области, приводило к замене цитозина (С) на тимин (Т) в позиции –589, с увеличением транскрипционной активности гена [4; 9].
У носителей гомозиготного генотипа –589СС гена IL-4 определялось снижение противовоспалительной активности IL-4 [4], что характеризовалось снижением продукции С-РБ и наличием прямой умеренной корреляцией (r=0,65, р<0,05).
Генотип G/G локуса G-1082A гена IL-10 активирует противовоспалительное звено иммунной системы [10]. Фенотипически наличие генотипов А/А связано с низкой продукцией самого IL-10 (r=0,32, р<0,05), что ведет к повышенному содержанию провоспалительных цитокинов и переходу воспаления в хроническую форму [9]. У больных с гомозиготным генотипом –1082GG выявлена ассоциация со снижением уровня С-РБ и ХС (r=0,6, р<0,05).
Изучение корреляционных взаимосвязей генотипов генов про- и противовоспалительных интерлейкинов выявило активность генотипов –511TT гена IL-1β, –174CC гена IL-6 и –1082GG гена IL-10 в поддержании стабильности атеросклеротической бляшки (r=0,46, p<0,05).
Таким образом, реализация гиполипидемического и противовоспалительного эффектов розувастатина у больных ИБС с сопутствующей ОРВИ обусловлена полиморфизмом генов про- и противовоспалительных цитокинов, что позволяет подбирать эффективную фармакотерапию нарушений липидного профиля, основанную на персонализированном подходе.
Выводы
1. Наличие генотипов ТT/CC по полиморфизму –511C>T гена IL-1β, СС/GC по полиморфизму –174G>C гена IL-6, ТT по полиморфизму –589С>T, GG/AG по полиморфизму –1082G>A гена IL-10 привело к достижению целевого уровня ХС ЛНП при монотерапии розувастатином 10 мг/сут.
2. Индивидуальный подход к фармакотерапии ГЛП у больных ИБС в условиях ОРВИ показал необходимость титрации дозы розувастатина до 20 мг/сут. с целью достижения целевого уровня ХС ЛНП у больных-гетерозигот CT по полиморфизму –511C>T гена IL-1β, гомозигот GG по полиморфизму –174G>C гена IL-6, гетерозигот CT по полиморфизму –589С>T гена IL-4 и гомозигот AA по полиморфизму –1082G>A гена IL-10.
3. Носители генотипа –589СС по полиморфизму –589С>T гена IL-4 при отсутствии лекарственного ответа на статинотерапию в дозе 20 мг/сут. нуждались в назначении более высоких доз.



