Несмотря на значительные усилия, направленные на профилактику и борьбу с диабетом и его осложнениями, согласно данным Международной диабетической ассоциации в настоящее время этим заболеванием страдают более 463 миллионов человек в мире, диабет является седьмой по значимости причиной смертности [1]. Длительное воздействие хронической гипергликемии без надлежащей терапии может приводить к различным сосудистым осложнениям и является основной причиной заболеваемости и смертности у больных диабетом. По оценкам Всемирной организации здравоохранения, в 2040 г. заболеваемость диабетом может составить около 642 миллионов человек [2]. Это обусловливает необходимость поиска новых терапевтических стратегий для лечения диабета, одним из перспективных направлений является применение нанотехнологий. Золотые наночастицы в связи с их низкой токсичностью и наличием антиоксидантных свойств [3] являются перспективными агентами для направленной доставки гипогликемических препаратов в диабетологии [4, 5]. Значительное влияние на эффекты наночастиц in vivo может оказывать характер покрытия наночастиц [6, 7], особенно в условиях развития в организме патологических процессов.
Цель исследования: оценить влияние покрытия золотых наностержней на морфологические изменения во внутренних органах при внутривенном введении у крыс с аллоксановым диабетом.
Материалы и методы исследования
Экспериментальное исследование на лабораторных животных было выполнено на базе ЦКП СГМУ им. В.И. Разумовского. Белым беспородным крысам-самцам внутривенно вводили золотые наностержни (ЗНС) (концентрация золота 400 мкг/мл), покрытые полиэтиленгликолем (PEG) и полистиролсульфонатом (PSS). Синтез и вычисление параметров ЗНС проводили в лаборатории нанобиотехнологии и в ЦКП «Симбиоз» ИБФРМ РАН (г. Саратов). Определение длины и диаметра ЗНС осуществляли по трансмиссионным электронно-микроскопическим (ТЭМ) изображениям микроскопа Libra-120 (Carl Zeiss, Germany). Средние размеры ЗНС составили: длина 41±8 нм и диаметр 10±2 нм.
При исследовании на лабораторных животных учитывали требования положений Европейской конвенции защиты позвоночных животных для экспериментальных и других научных целей (Страсбург, 1986), рекомендации комитета по этике ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ (протокол № 6 от 06.02.2018 г.).
Крысы случайным образом были распределены на 6 групп – 1 контрольная и 5 опытных. Контрольная группа была представлена интактными животными. Животным первой и второй опытных групп внутривенно вводили по 1 мл ЗНС с покрытием PEG и PSS соответственно. Крысам остальных опытных групп моделировали диабет посредством внутрибрюшинного введения аллоксана моногидрата (Sigma, США) из расчета дозы 100 мг/кг. Глюкометром Accu-Chek Performa Roche (Швейцария) измеряли концентрацию уровня глюкозы в крови. Крысам четвертой и пятой опытных групп на 15-е сутки после формирования аллоксанового диабета внутривенно вводили ЗНС, покрытые PEG и PSS соответственно. Через сутки после внутривенного введения животные всех групп выводились из опыта методом декапитации, у них забирали сыворотку крови и образцы внутренних органов для морфологического исследования.
Перекисное окисление липидов оценивали на спектрофлуориметре RF-5301 PC (Shimadzu Corporation, Япония) по изменению показателей концентрации в сыворотке крови промежуточных продуктов – малонового диальдегида (МДА) и гидроперекисей липидов (ГПЛ).
При морфологическом исследовании использовали стандартный протокол приготовления материала. Фрагменты печени, почек и селезенки фиксировали в растворе забуференного 10%-ного формалина, помещали в спиртовую проводку и после заливки в парафин окрашивали гематоксилином и эозином. Наличие в тканях гликогена определяли с помощью окрашивания препаратов реактивом Шиффа (ШИК-реакция). Морфометрические исследования проводили с использованием системы анализа цифровых изображений Микровизора медицинского (µVizo-103 ЛОМО).
Статистическую обработку данных проводили с использованием пакета статистических программ SSPS-13.0. Проверку нормальности распределения значений в выборке осуществляли с помощью теста Колмогорова–Смирнова. В случае нормального распределения определяли среднее арифметическое и стандартную ошибку, различия между группами вычисляли с использованием критерия Крамера–Уэлча. Если распределение отличалось от нормального, рассчитывали медиану, квартили и достоверность различий (р) с применением непараметрического критерия Манна–Уитни.
Результаты исследования и их обсуждение
Проведенные исследования показали, что при однократном внутривенном введении ЗНС с различным покрытием в органах у здоровых крыс развиваются дистрофические изменения паренхиматозных элементов и нарушения кровообращения в строме (отек и полнокровие), более выраженные в группе с внутривенным введением PSS-покрытых ЗНС. При морфологическом исследовании почек в корковом веществе на фоне полнокровия капилляров было обнаружено незначительное расширение клубочков. Канальцы имели округлую или овальную форму, при внутривенном введении PSS-покрытых ЗНС в эпителиальных клетках развивалась белковая дистрофия. Просвет большинства канальцев имел суженный вид вследствие увеличения высоты эпителия до 17,4±0,8 мкм (при значениях в контрольной группе 15,3±1,3 мкм). В печени гистоархитектоника органа была сохранена, отмечались умеренно выраженное венозное полнокровие органа и при введении PSS-покрытых ЗНС – дистрофия гепатоцитов незначительной степени выраженности. В селезенке красная пульпа преобладала над белой пульпой, граница различалась отчетливо, лимфоидные фолликулы не имели светлых центров.
При биохимическом исследовании продуктов перекисного окисления в сыворотке крови липидов изменения были обнаружены только в группе введения ЗНС, покрытых PSS: концентрация малонового диальдегида превысила показатели контрольной группы в 3 раза и составила 1,6 [1,27; 1,82].
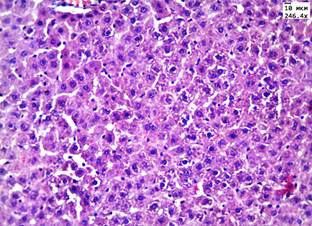
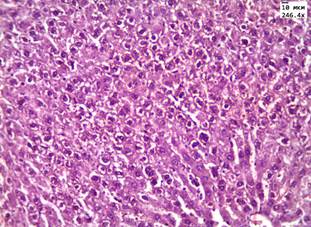
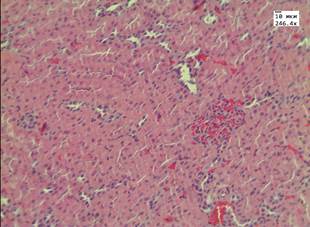
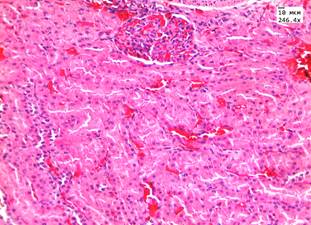
Введение аллоксана сопровождалось появлением у животных полидипсии, полиурии, в сыворотке крови на 15-е сутки после введения аллоксана отмечалось повышение уровня глюкозы в 3 раза по сравнению с группой контроля – до 18,5 ммоль/л. Летальность животных в данных группах на 5-е сутки составила 8,3%. При морфологическом исследовании в группах с аллоксановым диабетом в почках и печени обнаружены признаки, характерные для повреждения паренхимы органа при гипергликемии (рис. 1, А, В).
|
А) |
Б) |
|
В) |
Г) |
Рис. 1. Печень в группе животных с диабетом: А) при введении ЗНС, покрытых PEG; Б) при введении ЗНС, покрытых PSS. Почки в группе животных с диабетом: В) при введении ЗНС, покрытых PEG; Г) при введении ЗНС, покрытых PSS. Гематоксилин-эозин. Ув. х246,4
В почках наблюдались признаки нарушения кровообращения в виде отека стромы, умеренного полнокровия сосудов и наличия плазматического пропитывания в стенках мелких артериол. В корковом веществе в клубочках отмечалось увеличение капсулы Шумлянского–Боумена за счет отека. При морфометрическом исследовании обнаружено увеличение площади клубочков на 25% по сравнению с показателями в контрольной группе до 9,3±0,4 мм2 за счет умеренного полнокровия капилляров. Просвет извитых канальцев был сужен, эпителий находился в состоянии умеренно выраженной дистрофии. При морфометрическом исследовании обнаружено увеличение высоты эпителия извитых канальцев до 19,5±0,8 мкм (в контроле 15,3±1,3 мкм). При окрашивании реактивом Шиффа в цитоплазме эпителия и в просвете канальцев отмечались ШИК-положительные включения – гранулы гликогена. При морфологическом исследовании печени балочное строение было сохранено, наблюдалось умеренно выраженное полнокровие центральных вен и синусоидов. В пятой опытной группе с введением ЗНС, покрытых PSS, в половине наблюдений в корковом веществе почек были обнаружены очаговые лимфоидные инфильтраты. В чашечно-лоханочной системе во всех случаях обнаружены атрофические изменения уротелия. В гепатоцитах отмечалась дистрофия различной степени выраженности, имелись участки фокального некроза (рис. 1, Б).
При окрашивании реактивом Шиффа в цитоплазме гепатоцитов регистрировалось снижение уровня гликогена, что вероятнее всего связано со снижением его концентрации в тканях на фоне моделированного аллоксанового диабета. При морфометрическом исследовании печени определяли количество гепатоцитов с дистрофическими изменениями в цитоплазме и в состоянии некроза, подсчитывали число непаренхиматозных элементов печени (НПЭ) и двуядерных гепатоцитов. В качестве НПЭ печени учитывали лимфоциты, клетки Купфера и клетки Ито. Результаты морфометрического исследования представлены в таблице 1.
Во всех опытных группах с моделированным аллоксановым диабетом обнаружены признаки повреждения паренхимы печени, проявляющиеся в виде значительного повышения числа гепатоцитов, находящихся в состоянии некроза, – до 49 [31;57], что в 3 раза превышает значение показателя в контрольной группе. Степень выраженности некробиотических процессов в паренхиме печени оценивали с использованием коэффициента нормализации паренхимы (КНП). КНП определяли как отношение числа гепатоцитов с дистрофическими изменениями к гепатоцитам в состоянии некроза на поле зрения (х774).
Во всех опытных группах с моделированным аллоксановым диабетом установлено достоверное снижение КНП по сравнению с группой контроля. Минимальные значения КНП – 0,7 – были получены в группе моделированного аллоксанового диабета с введением ЗНС, покрытых PSS.
Таблица 1
Результаты морфометрических исследований в печени
|
Группы наблюдения |
Морфометрические показатели в поле зрения |
||||
|
Количество гепатоцитов с дистрофи-ческими изменениями |
Количество гепатоцитов в состоянии некроза |
КНП |
Количество НПЭ печени |
Количество двуядерных гепатоцитов |
|
|
Контрольная |
39 [33;43] |
15 [13;19] |
2,6 |
7[5;8] |
|
|
ЗНС (PEG) |
43 [37;47] |
17 [13;19] |
2,5 |
4[3;5] |
5 [3;7] |
|
ЗНС (PSS) |
45 [39;48] |
19 [14;21] |
2,3 |
5[3;7] |
4 [3;6] |
|
Диабет |
41 [40;59] |
49 [31;57]* |
0,83* |
13[10;17]* |
1 [1;2]* |
|
Диабет + ЗНС (PEG) |
32 [25;35] |
37 [33;39]* |
0,86* |
21[18;24]* |
1 [0;2]* |
|
Диабет + ЗНС (PSS) |
35 [27;42]* |
50 [36;59]* |
0,7* |
22[13;25]* |
2 [1;3]* |
*– p<0,05 достоверность отличия с контрольной группой
Воздействие на макрофагальную систему печени оценивали по результатам подсчета числа НПЭ – лимфоцитов, резидентных макрофагов (клеток Купфера и Ито) в поле зрения (х774). У животных с моделированным аллоксановым диабетом введение ЗНС, покрытых PEG и PSS, сопровождалось увеличением числа НПЭ печени до 21 [18;24] и 22 [13;25] соответственно, что в 3 раза превышало показатели в контрольной группе.
Для оценки выраженности пролиферативных процессов подсчитывали количество двуядерных гепатоцитов в поле зрения (х774). Во всех опытных группах с моделированным диабетом было установлено уменьшение в 5 раз количества двуядерных гепатоцитов по сравнению с группой контроля.
В группах с моделированным диабетом в селезенке строма органа имела нормальное строение, красная пульпа преобладала над белой, граница между ними различалась отчетливо. Лимфоидные фолликулы имели обычные размеры, округлую или овальную форму и были представлены скоплениями Т- и В-лимфоцитов, плазмоцитами и макрофагами, без светлых центров размножения.
В сыворотке крови крыс с моделированным аллоксановым диабетом во всех опытных группах происходило увеличение количества МДА и ГПЛ по сравнению с группой контроля (табл. 2). В опытной группе с моделированным аллоксановым диабетом без введения ЗНС наблюдалось увеличение концентрации МДА до 0,97 [0,64; 1,24] и ГПЛ до 3,1 [1,89; 3,3].
Таблица 2
Содержание МДА и ГПЛ в сыворотке крови
|
Группы наблюдения |
МДА, мкмоль/л |
ГПЛ, ед/мл |
|
Контрольная |
0,53 [0,48; 0,71] |
0,93 [0,78; 1,25] |
|
ЗНС (PEG) |
0,52 [0,48; 0,58] |
0,82 [0,68; 0,98] |
|
ЗНС (PSS) |
1,6 [1,27; 1,82]* |
1,5 [1,15; 1,82] |
|
Диабет |
0,97 [0,64; 1,24]* |
3,1 [1,89; 3,3]* |
|
Диабет + ЗНС (PEG) |
1,39 [0,79; 2,07]* |
3,65 [3,48; 4,2]* |
|
Диабет + ЗНС (PSS) |
2,5 [2,3; 2,75]*,** |
3,77 [3,46; 4,12]*,** |
*– достоверность отличия от контрольной группы (p<0,05), ** – от группы с диабетом (p<0,05)
Внутривенное введение ЗНС сопровождалось еще более значимым накоплением продуктов перекисного окисления липидов в сыворотке крови. Максимальное повышение уровня МДА до 2,5 [2,3; 2,75] и ГПЛ до 3,77 [3,46; 4,12] наблюдалось в опытной группе крыс с введением ЗНС, покрытых PSS. Следует отметить, что внутривенное введение ЗНС, покрытых PEG, крысам с моделированным аллоксановым диабетом, несмотря на повышение титра МДА и ГПЛ, не сопровождалось развитием достоверных изменений по сравнению с группой животных с аллоксановым диабетом.
Таким образом, внутривенное введение ЗНС с покрытием PEG и PSS лабораторных крысам с моделированным аллоксановым диабетом сопровождалось появлением морфологических изменений в органах (повреждением паренхимы вплоть до развития участков некроза, отеком, полнокровием стромы, пролиферацией лимфоидных клеток и макрофагов) и накоплением в крови продуктов перекисного окисления липидов (МДА и ГПЛ). Наиболее выраженные изменения были обнаружены нами в опытной группе введения ЗНС, покрытых PSS. Полученные данные о влиянии покрытия при воздействии ЗНЧ на морфологию внутренних органов согласуются с результатами работ ряда авторов [6, 7] и ранее выполненных нами исследований [8, 9].
Заключение
Проведенные исследования показали, что в печени и почках крыс всех опытных групп с моделированным аллоксановым диабетом развивались дистрофические и некротические изменения в паренхиме, отек и полнокровие стромы, пролиферация лимфоидных клеток и макрофагов. Наиболее выраженные морфологические изменения и наибольшее накопление продуктов липопероксидации были обнаружены в опытной группе с введением ЗНС, покрытых PSS. Полученные результаты вероятнее всего связаны с наличием отрицательного заряда у полистиролсульфонатной оболочки ЗНС. Внутривенное введение ЗНС, покрытых полиэтиленгликолем, не вызывало значительных морфологических изменений во внутренних органах у животных с аллоксановым диабетом, что позволяет рекомендовать их использование в исследованиях на животных с моделированными патологическими процессами.
Конфликт интересов. Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с настоящей статьей.
Исследование проведено в рамках реализации государственного задания Минздрава России.