Кардиоэзофагеальный рак (КЭР) характеризуется высокой частотой рецидивов после оперативного лечения и низкими показателями пятилетней выживаемости - менее 40% для всех стадий [1]. В связи с этим является актуальной разработка новых методов лечения КЭР, которая включает в себя доклинические исследования в данном направлении. В большинстве случаев доклинические исследования при раке пищевода выполняются на подкожных ксенотрансплантатах [2]. Однако все более часто в исследовательскую практику входят эксперименты с использованием ортотопических моделей [3]. При их создании на иммунодефицитных мышах опухолевые клетки вводят либо непосредственно в стенку пищевода, либо пересаживается фрагмент опухоли, выросшей подкожно после инъекции клеточной культуры [4]. Хирургические манипуляции при имплантации опухолевого материала в пищевод животных-реципиентов технически сложны из-за расположения и малого размера пищевода у мышей, особенно его абдоминальной части. Ортотопические ксенографты имеют преимущества по сравнению с гетеротопическими подкожными благодаря сходству микроокружения опухолевых клеток в модельном организме с донорским. Многочисленные исследования показали, что микроокружение играет важную роль в канцерогенезе: выделяемые биологически активные вещества (гормоны, факторы роста, цитокины и др.) и стволовые клетки, находящиеся в перитуморогенной зоне, способствуют прогрессированию злокачественного процесса [5]. Микроокружение при росте подкожных ксенографтов значительно отличается от такового в ортотопическом сайте, в том числе и из-за различий в кровоснабжении регионов, играющем важную роль в распространении метастазов по организму [6].
Модели, полученные в результате имплантации культур опухолевых клеток, широко используются как в экспериментальных, так и в доклинических исследованиях противоопухолевых препаратов, однако они не способны воспроизводить все многообразие биологических характеристик опухолей пациентов, поскольку представляют собой однородные клеточные сообщества в отличие от гетерогенных опухолей, развивающихся в человеческом организме. Эту проблему решают пациентоподобные ортотопические модели (Patient derived xenografts, далее - PDX), получаемые в результате трансплантации опухолевого материала пациентов. PDX отличаются плохо прогнозируемой скоростью роста и относительно низкими показателями приживления по сравнению с ксенографтами опухолевых культур клеток [7]. Однако их несомненным преимуществом является наиболее адекватное отражение особенностей туморогенеза в организме онкобольных, благодаря чему они считаются перспективными для использования в доклинических исследованиях.
Поскольку в последнее время наблюдается общемировая тенденция к росту доли аденокарцином пищевода в структуре рака пищеводно-желудочного соединения [8], то разработка ортотопических ксенотрансплантатов аденокарциномы пищевода является актуальной задачей.
Целью работы являлось создание PDX-модели аденокарциномы кардиоэзофагеального перехода на иммунодефицитных мышах после предварительной подкожной перевивки, исследование темпов роста опухоли и возможности ее метастазирования.
Материал и методы исследования
Опухолевый материал
Первичный фрагмент опухоли был взят от пациента И. с диагнозом инфильтративно-язвенный рак нижней трети пищевода с переходом на кардиальный отдел желудка. От пациента было получено письменное согласие на передачу биологического материала.
Животные
Реципиентами опухолевого материала являлись иммунодефицитные мыши Balb/c Nude массой 19-22 г, полученные из «SPF-вивария» ИЦиГ СО РАН (г. Новосибирск). Мыши содержались в SPF-виварии в ИВК-системе в помещении с контролируемыми параметрами микроклимата (температура 18-25 °C, влажность 30-60%, световой режим день-ночь).
Фрагменты опухоли от пациента размером 2×2 мм3 пересаживали 20 мышам подкожно. Далее выполнили создание трех последовательных генераций PDX. В качестве донорского материала использовали фрагменты размером 2×2 мм3 ксенографтов предыдущих пассажей, имплантируя их мышам (n=10 для каждого пассажа) в нижнюю треть пищевода ранее разработанным нами способом [9]. Таким образом, создавали ортотопическую пациентоподобную модель рака пищевода на иммунодефицитных мышах после предварительной подкожной перевивки. Подкожная перевивка опухолевого материала, полученного от пациента, позволила получить достаточный объем опухолевого материала для последующей генерации ксенографтов при воспроизводимых гистологических характеристиках.
Наблюдение за животными после ортотопической имплантации PDX проводили в течение 30 суток. Контролировали вес животных, общее состояние, объем опухолевого узла и распространение опухоли на соседние органы. После эвтаназии мышей проводили некропсию. Размеры и распространение опухоли оценивали по результатам морфологических исследований.
Анализ роста опухолевых ксенографтов
Замеры опухолевых узлов при подкожной имплантации выполняли при помощи штангенциркуля.
Замеры опухолевых узлов при ортотопической имплантации in vivo выполняли при помощи ультразвукового цифрового диагностического сканера SA R-3-RUS (SUMSUNG MEDISON CO., LTD, Корея) с использованием мультичастотного линейного датчика, работающего в диапазоне 6–15 МГц, выполняя ультразвуковое исследование через водный болюс. В процессе проведения УЗИ в зоне трансплантации оценивали границы и эхогенность узлового образования.
Размеры ксенографтов рассчитывали по формуле Шрека для эллипсоида: V=а×в×с×p/6, где V – объем опухоли (мм3), а, в, с – максимальные диаметры эллипсоида в трех плоскостях (мм).
Гистологический анализ
Фрагменты опухолей фиксировали в 10%-ном формалине в течение 24 ч и заключали в парафин. Затем готовили микросрезы, которые окрашивали гематоксилином и эозином. Проводили гистологическое исследование человеческой опухоли-донора, подкожного и ортотопических ксенографтов.
Статистический анализ
Статистический анализ результатов исследования выполнили с помощью программы STATISTICA 12.0 (StatSoft Inc., США). Данные представлены в виде выборочного среднего значения, стандартного отклонения. Достоверность различий средних величин независимых выборок оценивали с помощью параметрического критерия Стьюдента.
Результаты исследования и их обсуждение
В первом пассаже в подкожный сайт наблюдался рост опухоли только у одной мыши из 20. Увеличение объема ксенографта наблюдалось с 6-го дня, а усиление темпов роста опухоли наблюдалось на 12-й день после трансплантации. Конечной точкой роста опухоли было достижение на 20-й день после имплантации размера 219 мм3, необходимого для перевивки в ортотопический локус (рис. 1).
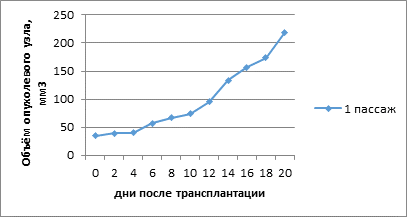
Рис. 1. Объем опухолевого узла подкожного пациентоподобного ксенографта. 1 пассаж
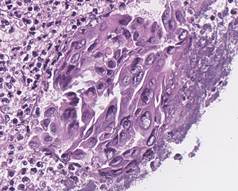
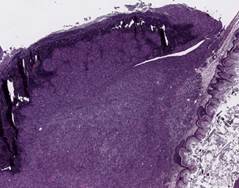
В результате гистологического анализа слизистой пищевода больного И. – донора опухолевого материала и подкожного ксенографта в первом пассаже был установлен один и тот же тип опухоли - умеренно дифференцированная аденокарцинома пищевода (рис. 2).
|
|
|
|
А |
В |
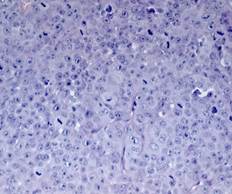
Рис. 2. Гистологическое исследование слизистой пищевода больного И. Умеренно дифференцированная аденокарцинома. Линией и стрелкой указана зона инвазии и воспаления. Справа представлены атипичные клетки. Окраска гематоксилин-эозином.
А – увеличение х20, В – увеличение х40
Объем опухолей к концу наблюдений во втором, третьем, четвертом пассажах увеличивался, что составило 308,3±2,9 мм3, 314,0±3,5 мм3 и 401,4±4,7 мм3 соответственно. Темпы роста ортотопического ксенографта у иммунодефицитных мышей от второго до четвертого пассажа последовательно повышались. Наблюдалось статистически значимое отличие объемов опухолевых узлов в ксенографтах в четвертом пассаже от таковых во втором-третьем пассажах (рис. 3).
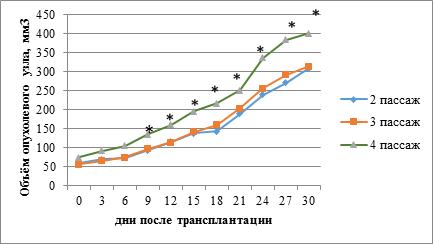
Рис. 3. Объемы опухолевых узлов ортотопических пациентоподобных ксенографтов во 2-4 пассажах. * - достоверные различия по критерию Стьюдента при р≤0,05
За время эксперимента наблюдалось снижение веса мышей, начиная с 5-го дня после ксенотрансплантации и вплоть до конца эксперимента. Статистически значимые различия веса животных в день n с исходным уровнем были выявлены уже через 10 дней после имплантации.
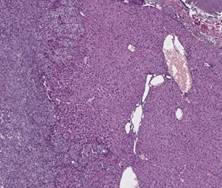
При макроскопическом анализе после эвтаназии мышей отчетливо выявлялись множественные метастатические опухолевые очаги в брюшине, печени и селезенке (рис. 4).
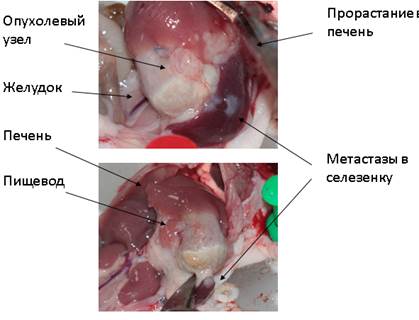
Рис. 4. Прорастание опухоли в печень и селезенку у иммунодефицитных мышей при росте ортотопического пациентоподобного ксенографта. Данные некропсии
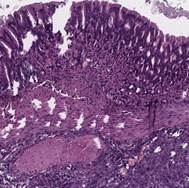
Гистологические исследования показали, что в четвертом пассаже ортотопическая опухоль содержала множественные опухолевые узлы с инвазией из адвентиции в слизистую оболочку дистального отдела пищевода, в отличие от второго и третьего пассажей, где инвазия опухолевого узла в слизистую оболочку часто отсутствовала. Также в четвертом пассаже крупные опухолевые узлы локализовались во всех оболочках пищевода, обусловливая его сужение, часто встречались изъязвления слизистой в просвет пищевода мыши, периневральная опухолевая инфильтрация, метастазы в лимфатических узлах, редко – очаговая кератинизация. Были отмечены случаи прорастания опухоли в желудок, печень, селезенку в третьем и четвертом пассажах (рис. 5).
|
|
|
|
|
А |
В |
С |
Рис. 5. Опухолевое поражение органов после трансплантации пациентоподобного ксенографта в кардиоэзофагеальную область иммунодефицитных мышей.
Окраска гематоксилином и эозином. Ув. х40. А – желудок, В – печень, С – селезенка
Повышенный интерес к PDX-моделям обусловлен их способностью преодолеть ограничения ксеногенных моделей культурального происхождения, связанные с отсутствием гетерогенности и развитием микросреды, отличной от таковой в реальных опухолях [10]. Преимущество PDX-моделей заключается в том, что они лучше воспроизводят основные характеристики злокачественных новообразований благодаря сохранению разнообразия клеточных субклонов и особенностей микроокружения при имплантации опухолевого материала от пациента непосредственно в иммунодефицитную мышь, как это было выполнено в данной работе.
В ходе работы при создании первого пассажа ксенографта была выполнена подкожная (гетеротопическая) имплантация фрагмента опухоли человека.
По литературным данным, приживление ксенотрансплантата в организме реципиента происходит в течение 2-4 месяцев и зависит от типа злокачественного новообразования, расположения импланта и линии мышей с иммунодефицитом [11]. Показатели успеха при создании PDX-моделей во многом зависят от характеристик первичной опухоли, таких как агрессивность, гистологический тип и процента опухолевых стволовых клеток в имплантируемом фрагменте [12]. В данной работе при создании первого пассажа рост опухолевого узла был отмечен на 6-й день, объем ксенографта достиг размера 219 мм3 на 20-й день.
Также важным фактором является размер (не менее 1×1 мм3) и количество имплантированной ткани – использование большего количества фрагментов имеет тенденцию к увеличению шанса на успех [13]. В нашей работе при создании первого пассажа приживление донорской ткани и дальнейший активный рост подкожного опухолевого узла было зафиксировано у 1 животного из 20 и составило 5%, что совпадает с литературными данными [13].
В связи с тем, что подкожный PDX редко вызывает метастазирование у мышей и не способен имитировать первоначального микроокружения опухоли [14], в ходе последующих пассажей была выполнена ортотопическая пересадка опухолевых фрагментов в соответствующий анатомический орган (рис. 4). При ортотопической имплантации во всех пассажах наблюдалось 100%-ное приживление опухоли.
По результатам макро- и микроскопических исследований у ортотопических PDX-моделей было отмечено метастазирование в печень, селезенку, желудок (рис. 4, 5).
Также при ортотопической имплантации было зафиксировано выраженное снижение веса животных вплоть до кахексии спустя месяц после трансплантации опухоли, что обусловлено как ростом опухоли, так и дисфагией вследствие частичной обструкции пищевода.
Кроме того, при анализе динамики роста ксенографтов в ряду последовательных пассажей, было показано статистически значимое увеличение объема опухолевых узлов в 4-м пассаже, в сравнении с 3-м и 2-м (р≤0,05), что говорит о процессе изменения некоторых биологических характеристик опухолевой ткани, при сохранении гистотипа исходной опухоли во всех поколениях ксенографтов. Полученные результаты согласуются с результатами исследований ряда авторов и их рекомендациями использовать в доклинических исследованиях PDX-модели более ранних генераций, предварительно проведя анализ на генетическую и гистологическую идентичность исходной опухоли [15].
Заключение
Кардиоэзофагеальный рак является агрессивным злокачественным новообразованием с присущей ему устойчивостью к современным химио- и радиотерапевтическим воздействиям, что проявляется высокой частотой рецидивов, метастазирования и плохой выживаемостью пациентов [16]. Учитывая низкую ответную реакцию аденокарцином пищеводно-желудочного перехода на современные схемы лечения, актуальным является изучение новых терапевтических стратегий, которые принимают во внимание иммунологический, а также молекулярно-генетический тип опухоли, опухолевое микроокружение, что требует разработки экспериментальных моделей кардиоэзофагеального рака на животных с устойчивыми трансплантационными и биологическими характеристиками.
В работе было проведено исследование особенностей роста пациентоподобных подкожных и ортотопических ксенографтов кардиоэзофагеального рака человека на иммунодефицитных мышах, показавшее увеличение динамики роста и метастатического потенциала опухоли с возрастанием кратности пассажей.
Авторы заявляют об отсутствии возможных конфликтов интересов.