Лечение термических поражений до настоящего времени остается одной из наиболее сложных проблем, имеющих не только медицинскую, но и социально-экономическую значимость, поскольку они составляют существенную долю среди всех остальных видов повреждений (4,1–4,5%), характеризуются высокими показателями летальности и инвалидизации, а также значительными финансовыми затратами на проведение лечения и реабилитации пострадавших [1, 2]. Стратегия поиска новых репарантов и перевязочных средств задействовала и использование препаратов на основе ацексамовой кислоты (ацетиламиногексановой кислоты), являющейся производным аминокапроновой кислоты [3]. Известно, что ацексамат цинка предотвращает появление острых экспериментальных дефектов слизистой желудка различного генеза и дуоденальных язв у крыс [4]. Вместе с тем синтезируются новые производные ацексамовой кислоты [5]. В связи с этим актуальной является оценка их биохимических механизмов, стимулирующих регенерацию тканей, для патогенетического обоснования коррекции репаративного процесса с помощью новых производных ацексамовой кислоты с целью разработки четких показаний и противопоказаний к применению.
Цель исследования: изучить в эксперименте на крысах эффективность использования нового производного N-ацетил-6-аминогексановой кислоты в виде 2%-ной мази при заживлении ожоговых ран с одновременной оценкой динамики показателей оксидативного стресса на этапах раневого процесса.
Материал и методы исследования. Исследование проведено на 45 белых неинбредных самках крыс средней массой 180–200 г в соответствии с положительным решением локального Этического комитета ФГБОУ ВО Тверской ГМУ Минздрава России, а также с требованиями ГОСТ Р ИСО 5725-1-2002, ГОСТ ИСО/МЭК 17025-2009, «Правил лабораторной практики», утвержденных приказом Минздравсоцразвития РФ от 23 августа 2010 г. № 708н, и с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Directive 2010/63/EU). Перед постановкой эксперимента животные проходили карантин в течение 14 дней. В условиях общей ингаляционной анестезии парами эфира [6] на депилированной поверхности кожи моделировали термический ожог III степени в межлопаточной области с помощью стального трафарета площадью 225 мм2 (температура накаливания 240°С, экспозиция 8 с). В качестве репаранта использовали 2%-ную мазь ЛХТ 2-18 нового производного N-ацетил-6-аминогексановой кислоты (ЛХТ 2-18), синтезированного АО «ВНЦ БАВ» (г. Старая Купавна), на основе полиэтиленгликоля.
Животных разделили на группы, отличающиеся по воздействию на область дефекта: крысам группы № 1 наносили мазевую основу, группы № 2 – ЛХТ 2-18 в виде 2%-ной мази. Крысам контрольной группы препараты не наносились, происходило спонтанное течение раневого процесса. Местные аппликации веществ проводили в течение 10 дней, ежедневно однократно после измерения площади ран начиная со вторых суток исследования.
Оценку динамики заживления ожогового дефекта осуществляли планиметрическим методом. Начиная со вторых суток после нанесения повреждения ежедневно на прозрачную пленку переносили контуры каждого дефекта, затем подсчитывали его площадь с помощью миллиметровой бумаги. Абсолютную площадь (S, мм2) поверхностного дефекта кожи рассчитывали по формуле [7]:
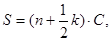
где n – количество квадратов размером 2,5×2,5 мм², полностью находящихся в пределах контура раны; k – количество квадратов размером 2,5×2,5 мм², частично находящихся в пределах контура раны; С – площадь одного квадрата размером 2,5×2,5 мм².
Для определения биохимических показателей у животных получали кровь из бедренной вены в объеме 3 мл и биоптаты тканей из области раневого дефекта. Из биоптатов готовили гомогенаты с помощью гомогенизатора «Minilys» (Bertin Instruments, Франция). Фотометрическим методом с применением тест-систем «Total Oxidative status/capacity PerOx (TOS) Kit» и «Total Antioxidative status/capacity PerOx (TAS) Kit» производства «Immundiagnostik AG» (Германия) определяли показатели оксидативного стресса (ОС) – общую оксидантную (TOS) и общую антиоксидантную (TAS) активности сыворотки крови и гомогенатов. Индекс оксидативного стресса (ИОС) определяли как отношение показателей TOS к TAS.
Статистический анализ данных выполняли с помощью программы IBM® SPSS® Statistcs 23.0 «IBM Corporation» (USA). Количественные данные представлены в виде среднего арифметического и стандартной ошибки среднего. Для оценки статистической значимости разности средних в двух группах применяли критерии Стьюдента и Манна–Уитни, в трех группах – Крускала–Уоллиса. Различия между показателями в группах считали статистически значимыми при p<0,05, констатировали наличие тенденции различий при p<0,1.
Результаты исследования и их обсуждение. В результате термического воздействия у экспериментальных животных развился ожог III Б степени с повреждением всех слоев кожи, составляющий 4–5% от общей площади поверхности тела.
В первые сутки после ожога животные всех групп были малоактивны, принимали пищу вяло, в небольших количествах. На третьи сутки после нанесения травмы двигательная активность и аппетит восстанавливались полностью у животных групп № 1 и № 2, тогда как у животных группы контроля отмечались признаки физиологического дискомфорта. Площадь дефекта у крыс группы контроля сокращалась медленно и на 21-е сутки еще составляла 43,3±5,49 мм2 (табл. 1).
Таблица 1
Динамика площади дефектов кожи крыс при регенерации термического ожога
|
Группы животных |
Площадь дефекта кожи (М±m), мм2 |
||
|
7 суток |
14 суток |
21 сутки |
|
|
Контроль |
215,5±3,74 |
126,1±3,50 |
43,3±5,49 |
|
№ 1 |
209,8±2,37 |
120,6±2,37 |
38,1±5,01 |
|
№ 2 |
176,0±12,62* |
48,5±6,71* |
0 (рубец)* |
Примечание: * – различие статистически значимо (р<0,05) между показателем у животных группы № 2 и групп контроля и группы № 1
К 7-м суткам эксперимента у животных 1-й и 2-й групп площади ожогов сократились в среднем на 18% и 20% соответственно, в то время как в контрольной – на 16%. На 17-е сутки эксперимента в группе № 2 наблюдалось отторжение фрагментов струпа, под которыми визуализировался соединительнотканный рубец. В контрольной группе полную эпителизацию отмечали лишь на 23-е сутки. У животных группы № 1 ко времени выведения животных из эксперимента площадь ран составляла 38,1±5,01 мм2.
Результаты количественного определения показателей оксидативного стресса (ОС) – TOS, TAS и ИОС – в сыворотке крови представлены в таблице 2.
Таблица 2
Показатели оксидативного стресса в крови крыс в динамике регенерации термического ожога кожи
|
Группы животных |
Показатели в крови, (M±m) |
|||
|
TOS, мкмоль/л |
TAS, мкмоль/л |
ИОС, ед. |
||
|
7 суток |
||||
|
Контроль |
17,6±1,48 |
4,82±0,54 |
4,45±0,77 |
|
|
№ 1 |
57,2±10,84 |
19,9±4,96 |
4,15±0,72 |
|
|
№ 2 |
58,0±10,84 |
21,2±4,93 |
3,78±0,62** |
|
|
14 суток |
||||
|
Контроль |
156,3±43,4 |
63,8±10,9 |
3,11±0,78 |
|
|
№ 1 |
159,4±46,9 |
75,4±12,98 |
2,76±0,62 |
|
|
№ 2 |
125,3±20,43 |
80,4±10,8 |
1,57±0,20* |
|
|
21 сутки |
||||
|
Контроль |
144,1±24,38 |
142,1±7,06 |
0,98±0,13 |
|
|
№ 1 |
135,0±26,12 |
146,86±8,66 |
0,86±0,12 |
|
|
№ 2 |
58,3±9,54 |
126,3±8,66 |
0,50±0,08* |
|
Примечание: * – различие статистически значимо (р<0,05) между показателем у животных группы № 2 и групп контроля и № 1; ** – имеется тенденция различий (р<0,1) между показателем у животных группы № 2 и групп контроля и № 1.
Динамика изменения значений TOS и TAS состояла в их увеличении в первые две недели наблюдений и снижении на третьей неделе эксперимента. Степень этих изменений была выражена по-разному, поэтому для последующей оценки активности протекания свободно-радикальных процессов использовали не абсолютные значения TOS и TAS, а их отношение, называемое ИОС.
Анализ ОС показал, что активность окислительных процессов и антиоксидантной защиты в сыворотке крови зависит от стадии раневого процесса. Так, для всех групп животных показатели ИОС в крови на 7-е, 14-е и 21-е сутки лечения термического ожога кожи по мере заживления дефекта снижались.
Однако достоверных различий показателей, характеризующих ОС, между группами контроля и группой № 1 на всех этапах наблюдения не обнаружено. У крыс группы № 2 на 7-е сутки эксперимента наметилась тенденция к снижению активности ОС относительно показателей у животных контрольной группы и группы № 1. Так, значение ИОС у животных группы № 2 по сравнению с крысами группы контроля и группы № 1 составило 84,9% и 91,1% соответственно (р<0,1). Выявленная тенденция различий в исследуемых группах по мере продолжения эксперимента усиливалась, при этом на 14-е и 21-е сутки снижение ИОС в группе № 2 стало статистически достоверным по сравнению с группой контроля и группой № 1. При этом на 14-е сутки ИОС у животных группы № 2 по сравнению с крысами группы контроля и группы № 1 составил 50,5% и 56,9%, а на 21-е сутки – 51,0% и 58,1%, соответственно (все р<0,05).
Результаты количественного определения показателей ОС в гомогенатах регенерирующих тканей представлены в таблице 3 и приведены в расчете на их содержание в биоптате и на 1 мг белка в гомогенате.
Таблица 3
Показатели оксидативного стресса в гомогенатах в динамике регенерации термического ожога кожи
|
Группы животных |
Показатели |
|||
|
TOS, мкмоль/л |
TAS, мкмоль/л |
ИОС, ед. |
||
|
7 суток |
||||
|
Контроль |
на биоптат |
17,3±2,03 |
2,46±0,17 |
7,09±0,80 |
|
на 1 мг белка |
1,03±0,15 |
0,15±0,02 |
||
|
№ 1 |
на биоптат |
17,0±2,52 |
2,67±0,23 |
6,84±0,94 |
|
на 1 мг белка |
1,11±0,19 |
0,18±0,03 |
||
|
№ 2 |
на биоптат |
15,43±2,35 |
4,21±0,65 |
3,93±0,57* |
|
на 1 мг белка |
0,73±0,10 |
0,21±0,04 |
||
|
14 суток |
||||
|
Контроль |
на биоптат |
173,3±11,9 |
35,1±4,05 |
5,96±0,83 |
|
на 1 мг белка |
11,1±1,13 |
2,19±0,28 |
||
|
№ 1 |
на биоптат |
153,9±12,2 |
38,6±4,88 |
4,72±0,52 |
|
на 1 мг белка |
13,2±1,85 |
3,06±0,43 |
||
|
№ 2 |
на биоптат |
161,9±9,96 |
61,8±4,22 |
2,75±0,26* |
|
на 1 мг белка |
8,47±0,54 |
3,33±0,35 |
||
|
21 суток |
||||
|
Контроль |
на биоптат |
151,9±8,02 |
170,1±11,6 |
0,92±0,04 |
|
на 1 мг белка |
7,73±0,24 |
8,55±0,31 |
||
|
№ 1 |
на биоптат |
148,1±6,80 |
180,9±10,6 |
0,86±0,07 |
|
на 1 мг белка |
7,38±0,68 |
8,87±0,63 |
||
|
№ 2 |
на биоптат |
102,9±5,12 |
162,3±7,64 |
0,66±0,05* |
|
на 1 мг белка |
4,92±0,31 |
7,82±0,55 |
||
Примечание: * – различие статистически значимо (р<0,05) между показателем у животных группы № 2 и групп контроля и № 1
Проведенное исследование показало, что у животных всех групп показатели ИОС в регенерирующих тканях по мере заживления дефекта снижались. При этом достоверных различий показателей ОС между группой контроля и группой № 1 на всех этапах наблюдения не выявлено. Однако применение исследуемой мази у животных группы № 2 на 7-е сутки эксперимента привело к статистически значимому снижению ИОС в гомогенатах тканей по сравнению с показателями контрольной группы и группы № 1, которое составило 44,6% и 42,5% соответственно (оба р<0,05). На 14-е и 21-е сутки эксперимента ИОС в гомогенатах тканей животных группы № 2 был достоверно ниже, чем в группах сравнения, и составил 46,1% и 46,2%, а на 21-е сутки – 71,7% и 76,7% соответственно (все р<0,05).
Определенная как в гомогенатах тканей из области раневого дефекта, так и в крови динамика показателей, характеризующих свободно-радикальные процессы в организме, свидетельствует о статистически значимом снижении активности ОС в процессе репарации термического ожога при местном лечении мазью, содержащей 2% нового производного N-ацетил-6-аминогексановой кислоты.
Сопоставляя динамику сокращения площади раневого дефекта с показателями ОС в крови, можно выявить некоторые закономерности. К 7-м суткам средняя площадь ожога в группе № 2 была в 1,2 раза меньше (р<0,05), чем в группе контроля, в то время как в группах № 1 и контроля эти показатели достоверно не различались. Одновременно ИОС в группе № 2 имели более низкие значения в сравнении с группой контроля – в 1,2 раз в крови и 1,8 раза в гомогенатах, что может служить признаком активно завершившейся фазы воспаления регенерации. Вместе с тем к этому же сроку значения ИОС в крови и гомогенатах тканей крыс группы контроля и группы № 1 были выше, чем в группе № 2 (р<0,05), но достоверно не различались между собой. Оценка этого факта указывает на два явления. Во-первых, регенерирующие ткани крыс группы контроля и группы № 1 все еще находятся под действием свободных радикалов. Во-вторых, стимулирующий эффект на заживление ожогов оказывает не мазевая основа, а действующее вещество ЛХТ 2-18 в составе мази.
К 14-м суткам исследования область ожоговых дефектов у крыс группы № 2 продолжала сокращаться высокими темпами, площадь струпа была в 2,6 раза меньше показателей контрольной группы, что, очевидно, связано с активными формообразовательными процессами фазы пролиферации. Косвенно это подтверждается тем, что у животных группы № 2 значения ИОС в крови и гомогенатах регенерирующих тканей были примерно в 2 раза ниже, чем в группе контроля, что определяется активацией антиоксидантной системы и подавлением активности окислительных процессов.
К 21-м суткам наблюдения в группе контроля и группе № 1 область бывшего дефекта еще находилась под плотно фиксированным струпом, составляя менее 1% от поверхности тела, в то время как в группе № 2 струп отделился и на месте дефекта визуализировался соединительнотканный рубец. На фоне процессов фазы эпителизации у крыс группы контроля и группы № 1 практически устраняется дисбаланс между оксидантными и антиоксидантными факторами и значения ИОС приближаются к единице. Однако у животных группы № 2 в данный период раневого процесса продолжалась активация антиоксидантной системы. Так, у крыс этой группы значение показателя TAS в два раза превышало уровень показателя TOS.
Заключение. Таким образом, отсутствие статистически значимых различий площадей раневых дефектов и показателей ОС как в биоптатах из области ран, так и в крови между контрольной группой и группой № 1 на всех стадиях раневого процесса свидетельствует о том, что аппликация ожоговых ран только мазевой основой не оказывает стимулирующего эффекта. При этом репаративный потенциал нового производного N-ацетил-6-аминогексановой кислоты в виде 2%-ной мази реализуется местно уже на стадиях воспаления и пролиферации. Вместе с этим его применение продемонстрировало прорегенераторные свойства, что проявилось в ускорении заживления экспериментальных термических ожогов и снижении в регенерирующих тканях и крови активности свободно-радикальных процессов, являющихся одними из патогенетических факторов раневого процесса.



