Злокачественные опухоли предстательной железы занимают 2-е место в структуре онкологической заболеваемости в России у мужчин всех возрастных групп. Причем в последнее десятилетие отмечают значительный рост заболеваемости, который составляет 143% и является самым высоким показателем среди опухолей других нозологий. [1].
Основными терапевтическими подходами при данной патологии являются радикальная простатэктомия и лучевая терапия (ЛТ) [2]. Последняя играет одну из ведущих ролей в лечении рака предстательной железы (РПЖ) [3], однако появление радиорезистентных форм диктует необходимость персонифицированного подхода, основанного на данных молекулярно-генетических маркеров [1].
Причины радиорезистентности активно изучаются. Одной из них может быть гиперактивация в опухолевых клетках таких механизмов, как репарация ДНК [4]. Как известно, баланс между повреждением и репарацией ДНК определяет выживаемость клеток после воздействия ионизирующего излучения [5]. Не менее важным фактором, оказывающим влияние на чувствительность опухолевых клеток к излучению, является гипоксия, с учетом роли кислорода в реакции образования активных форм кислорода (АФК), индуцированной облучением [6].
Несмотря на эволюцию методов лучевой терапии злокачественных опухолей предстательной железы и на то, что известны многие механизмы формирования радиорезистентности опухолей разных нозологий, в настоящее время отсутствует возможность достоверного определения чувствительности РПЖ к лучевой терапии. Поэтому проблема прогнозирования радиорезистентности остается актуальной. Для ее решения необходимы модельные эксперименты на клеточных культурах опухолевых клеток с оценкой влияния ЛТ на их выживаемость [7].
Выявление молекулярных маркеров радиорезистентности с последующим дифференцированным подходом к выбору тактики лечения может существенно повлиять на результаты терапии больных РПЖ в сторону их улучшения [1]. К подобным маркерам относится показатель копийности генов (Copy Number Variation (CNV)) – генетический полиморфизм, приводящий к снижению или повышению числа копий определенного гена и, как следствие, к снижению или повышению уровня молекулярного продукта гена – мРНК, не кодирующей РНК или белка [8].
Метаанализ (на основании данных, опубликованных с 2000 по 2020 г.) обобщил результаты лучевой терапии больных локализованным раком предстательной железы и показатели по изменчивости копийности генов, и позволил сформировать перечень потенциальных молекулярных маркеров, состоящий из 32 генетических локусов – компонентов сигнальных путей, регулирующих репарацию ДНК, клеточный цикл и апоптоз.
Поэтому целью исследования стала валидация в условиях модельного эксперимента потенциальных предикторов радиорезистентности клеток предстательной железы (показатель копийности генов), выбранных на основании данных метаанализа.
Материалы и методы исследования
В исследовании использовалась культура клеток человека – рака предстательной железы PC-3. Культивирование клеточной массы проводилось в стандартных условиях, описанных нами в предыдущих работах (стерильные плоскодонные флаконы, среда RPMI-1640 c 10% фетальной телячьей сывороткой, гентамицин 50 мкг/мл, 5% CO2, 95% влажности и 37 0C) [7].
Для модельного эксперимента использовали дозы 6 и 7 Гр (облучение проводили 5 раз через каждые 24 ч на линейном ускорителе Novalis TX). Подсчет клеток проводили в камере Горяева (0,4% раствор трипанового синего). На 5-й день облучения клетки PC-3 снимали с подложки раствором Трипсин/Версена. Количество клеток, находящихся на различных стадиях апоптоза, оценивали на проточном цитофлюориметре Facs Canto II с использованием Annexin V-FITC Apoptosis Detection Kit [7].
Из клеток фенол-хлороформным методом проводилась экстракция ДНК. Для определения относительной копийности генов нами, с использованием базы данных NCBI GenBank, были разработаны последовательности 32 пар синтетических олигонуклеотидов (BRCA1, BRCA2, AKT, ATM, BRIP, H2AX, EXO1, CDK1, XRCC4, RAD50, RAP80, RIF1, RNF168, TOPB1, KU70, CDKN1B, CCND1, CCND3, FGFR2, HIST1, RBBP8, EP300, LIG4, C-FLIP, PTEN, TP53, BAX, CASP8, CASP3, CASP9, MDM2, BCL2) и 3 пары для референсных локусов (ACTB, B2M, GAPDH) (табл. 1). Определение относительной копийности генетических локусов проводили методом Real-Time qPCR (RT-qPCR).
Таблица 1
Последовательности праймеров для определения копийности генов
|
№ |
Праймер |
Последовательность праймера |
Праймер |
Последовательность праймера |
|
1 |
AKT1_F |
ATGGACAGGGAGAGCAAACG |
AKT1_R |
TGATGCACCAGCTGACAGG |
|
2 |
ATM_F |
GCAAAACCAAATGTATCAGCCTCA |
ATM_R |
GACCAAACTACTGATTTCCTGCAT |
|
3 |
BRIP1_F |
GAAGAACTTGTCAGCCTGGGG |
BRIP1_R |
TCTTGTATTAGTTCTCGGGCTGTG |
|
4 |
BRCA1_F |
GTAGCCCCTTGGTTTCCGTG |
BRCA1_R |
CCCTTTCCCGGGACTCTACT |
|
5 |
BRCA2_F |
TGCATCCCTGTGTAAGTGCAT |
BRCA2_R |
ACGTACTGGGTTTTTAGCAAGC |
|
6 |
CDK1_F |
CAGGGGATTGTGTTTTGTCACT |
CDK1_R |
ACCACTATTCCACTTGCCTCAT |
|
7 |
CDKN1B_F |
TCGGGGTCTGTGTCTTTTGG |
CDKN1B_R |
CTCCCGTTAGACACTCGCAC |
|
8 |
CCND1_F |
GGTGAACAAGCTCAAGTGGAAC |
CCND1_R |
CCGGCCAGGGTCACCTAA |
|
9 |
CCND3_F |
TTCCACGGTTGCTACATCGT |
CCND3_R |
ACACAGCAGCTCCATACTCG |
|
10 |
EXO1_F |
GTTACCCGTGTTCTGCGTTG |
EXO1_R |
GAACCCACCCATTAGCCTCC |
|
11 |
FGFR2_F |
CAAGGACCACTCTTCTGCGT |
FGFR2_R |
CTTGAATGGCAACGCTCCTC |
|
12 |
HIST1H2_F |
CGTGCTACTGCCCAAGAAGA |
HIST1H2_R |
AGCCTTTGGTTCCTTTGGGAT |
|
13 |
H2AX_F |
AGGCCTCCCAGGAGTACTAA |
H2AX_R |
CTGAAGCGGCTCAGCTCTTT |
|
14 |
KU70_F |
AAGATCATAAGCAGTGATCGAGA |
KU70_R |
TCCAGCTCCTGTAAGACGTA |
|
15 |
PTEN _F |
GTCCAGAGCCATTTCCATCCT |
PTEN _R |
TGTCATGTCTGGGAGCCTGT |
|
16 |
RAD50 _F |
TGGCTGGCAGGATCTTTTGG |
RAD50 _R |
GCTTAACTGAGGCCGAAGCA |
|
17 |
RAP80_F |
CAGATGTACTGGCCACTCGG |
RAP80_R |
CAGTGCCTAGATGTGTCCCC |
|
18 |
RB1_F |
TCCGGTTTTTCTCAGGGGAC |
RB1_R |
CAGCGAGCTGTGGAGGAG |
|
19 |
Rif1_F |
GGCTGTTTCCATCGGTCACT |
Rif1_R |
TCCAAAGTCTCCAACAGCGG |
|
20 |
RNF168_F |
TGAGGGGAGGAGAGGACTTG |
RNF168_R |
AGGCAAACAGGAATACCCCG |
|
21 |
TGFB1 _F |
TTGAGACTTTTCCGTTGCCG |
TGFB1 _R |
GAGGGCTGGTCCGGAATG |
|
22 |
TopBP1 _F |
TGGGCGGACGAGTATACAGA |
TopBP1 _R |
AGGTTTCTTCAGGTTTGCAGC |
|
23 |
TP53 _F |
GGTCGGTGGGTTGGTAGTTT |
TP53 _R |
GTGTGGGATGGGGTGAGATT |
|
24 |
XRCC4 _F |
CAGACTTGGTTCCTTCAACCT |
XRCC4 _R |
TCTGCAGGTGCTCATTTTTGG |
|
25 |
BAX_F |
GCCTCCTCTCCTACTTTGGG |
BAX_R |
AAACACAGTCCAAGGCAGC |
|
26 |
CASP8_F |
TCTTTATGATATTGGGGAACAACTG |
CASP8_R |
GTTCTTGCTTCCTTTGCGGA |
|
27 |
CASP3_F |
ATGCAGCAAACCTCAGGGAA |
CASP3_R |
TTCACCATGGCTCAGAAGCA |
|
28 |
CASP9_F |
CTCCACTTCCCCTGAAGACG |
CASP9_R |
CTGGGTGTGGGCAAACTAGA |
|
29 |
MDM2_F |
TCTTTGGGACCCATCTACCCT |
MDM2_R |
AGAATGCTTTAGTCCACCTAACCTT |
|
30 |
BCL2_F |
GAGTGGGATGCGGGAGATG |
BCL2_R |
GGTGAAGGGCGTCAGGTG |
|
31 |
RBBP8 _F |
ACCGAGGATTTGGCACTCTG |
RBBP8 _R |
TCCGAGATTGCCTCGGGATT |
|
32 |
EP300_F |
TCGGCGAATTTGTGCTCTTG |
EP300_R |
CCTTTTTCTCTTCGCCGGGT |
|
33 |
LIG4 _F |
GGGTAAAGGATCACGGGGTG |
LIG4 _R |
CCAGACCCAACACGAGAGAG |
|
34 |
C-FLIP_F |
GGCTCCCAGAGTGTGTATGG |
C-FLIP_R |
GGCCCTCTGACACCACATAG |
|
35 |
GAPDH_F |
GCTGAACGGGAAGCTCACT |
GAPDH_R |
GCAGGTTTTTCTAGACGGCAG |
|
36 |
ACTB_F |
CACCCTGAAGTACCCCATCG |
ACTB_R |
TGTAGAAGGTGTGGTGCCAG |
|
37 |
B2M_F |
TGAGTGCTGTCTCCATGTTTGA |
B2M_R |
ATTCTCTGCTCCCCACCTCT |
Примечание. F – прямой праймер, R – обратный праймер
RT-qPCR амплификация проводилась на термоциклере Bio-Rad CFX96 (Bio-Rad, США), с использованием реакционной смеси, состоящей из однократного ПЦР-буфера, смеси 0,2 мМ dNTP, 2,0 мМ MgCl2, праймеров в концентрации 500 нМ, 0,1 ед. акт./мкл Taq-полимераза (Синтол, Россия) и 12 нг ДНК. В качестве красителя использовали EvaGreen Dye (Biotium, США). Амплификация каждого образца осуществлялась в трех технических повторах. Далее усредненные данные порогового цикла по каждому генетическому локусу нормировались по усредненному показателю порогового цикла для референсных генов (ΔCt=среднее Ct(исследуемого гена) – среднее геометрическое Ct(референсных генов)), и вычислялась величина rQ, равная 2-ΔCt. Далее вычисляли среднее rQоблученных клеток и среднее rQинтактных клеток (контроль) для каждого генетического локуса и соотношение RQоб/RQк, собственно и представляющее собой показатель относительной копийности генов в облученных образцах по отношению к контрольным [7].
Для статистической обработки данных применяли однофакторный дисперсионный анализ (One-Way ANOVA). Иерархический кластерный анализ и построение тепловых карт осуществляли в среде R (R-Studio 8.10.173.987), используя собственные скрипты. Алгоритм сравнения большего числа множеств (реализованн на JavaScript) использовался для построения диаграмм Эдвардса – Венна. Алгоритм FMD (Functional module detection) был применен для кластеризации генов по выполняемой ими функции, при этом Q-value каждого члена функционального модуля рассчитывалось с применением одностороннего точного критерия Фишера и поправки Бенджамини – Хохберга для корректировки множественного сравнения [9].
Результаты исследования и их обсуждение
В результате 5-дневного эксперимента по облучению в дозах 6 и 7 Гр клеток PC-3 на линейном ускорителе Novalis TX (Varian, США) около 50% от оставшихся опухолевых клеток (15% от изначального количества) сохранили свою жизнеспособность. Нами был проведен анализ дифференциальной копийности 32 генов в интактных (контрольных) и облученных клетках (рис. 1).
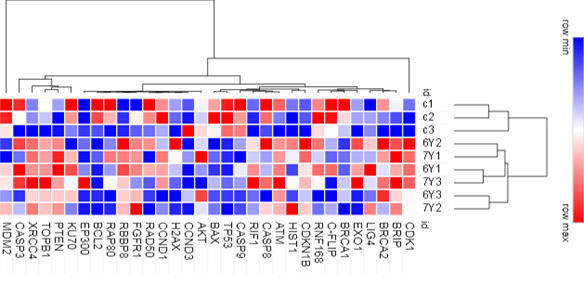
Рис. 1. Heatmap и кластерный анализ дифференциальной копийности 32 генов в интактных и облученных клетках PC-3
По особенностям уровня копийности в интактных и облученных образцах было выделено 4 основных кластера генов: 1 – (BRCA1, BRCA2, BRIP, RNF168, C-FLIP, EXO1, LIG4), 2 – (ATM, CDKN1B, HIST1, CASP8, TP53, RIF1, BAX), 3 – (AKT, CCND3, H2AX, CCND1, RAD50, FGFR2, RBBP8, EP300, RAP80, BCL2), 4 – (PTEN, KU70, TOPB1, MDM2, XRCC4, CASP3).
Таблица 2
Сходства и различия в показателе копийности генов между кластерами
|
Ген |
Кол-во сравниваемых групп, в которых повышен уровень копийности гена |
Копийность гена повышена в группах |
|
ATM |
9 |
C1, C2, C3, 6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
BRIP |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
CDK1 |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
MDM2 |
6 |
C1, C2, C3, 6Y1, 7Y2, 7Y3 |
|
PTEN |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
RBBP8 |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
TOPB1 |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
XRCC4 |
6 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
BRCA2 |
5 |
C1, 6Y2, 6Y3, 7Y1, 7Y3 |
|
CCND1 |
5 |
C1, C2, 6Y1, 7Y1, 7Y3 |
|
CDKN1B |
5 |
6Y2, 6Y3, 7Y1, 7Y2, 7Y3 |
|
FGFR1 |
5 |
6Y1, 6Y2, 6Y3, 7Y1, 7Y2 |
|
KU70 |
5 |
C1, C2, 6Y1, 6Y3, 7Y1 |
|
RNF168 |
5 |
C1, C2, C3, 6Y1, 6Y2 |
|
CASP3 |
4 |
C1, 6Y1, 6Y2, 7Y3 |
|
CASP8 |
4 |
C1, C2, 6Y2, 7Y3 |
|
RAD50 |
4 |
C1, C2, 6Y1, 6Y2 |
|
BAX |
3 |
C1, C2, C3 |
|
C-FLIP |
3 |
C1, C2, 6Y1 |
|
CASP9 |
3 |
C1, C2, C3 |
|
EXO1 |
3 |
6Y1, 6Y2, 7Y3 |
|
RAP80 |
3 |
C1, C2, 7Y1 |
|
RIF1 |
3 |
6Y1, 6Y2, 7Y3 |
|
TP53 |
3 |
C1, C2, C3 |
|
AKT |
2 |
6Y3, 7Y1 |
|
BCL2 |
2 |
C1, C2 |
|
BRCA1 |
2 |
C1, C2 |
|
HIST1 |
2 |
6Y2, 7Y2 |
|
LIG4 |
2 |
6Y1, 7Y2 |
Условные обозначения (здесь и на рис. 1 и 2): C – контроль, 6Y – доза 6 Гр; 7Y – доза 7 Гр
Также интактные и облученные клетки по схожести показателя копийности генов были объединены в кластеры (рис. 1). Вероятно, изначальное присутствие в клеточной линии PC-3 клонов, с определенным уровнем копийности рассматриваемых генов, и обеспечило выживание субпопуляции этих клеток, а также отразилось на формировании кластеров, объединяющих интактные и облученные клетки по сходству копийности некоторых генов, представленных на рис. 2 и в табл. 2.

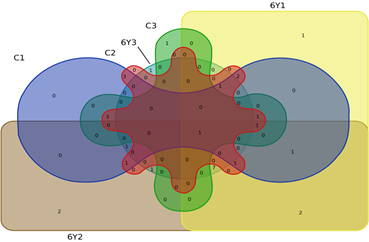
Рис. 2. Диаграмма Эдвардса – Венна (показано сходство по количеству генов с повышенной копийностью в 9 группах – 3 контрольных, 3 облученных в дозе 6 Гр и 3 в дозе 7 Гр)
На рис. 3 представлены данные, полученные после нормализации показателей копийности генов в облученных клетках относительно интактных. В клетках PC-3, подвергнутых облучению 6 Гр, статистически значимо была повышена копийность генов CDK1, CDKN1B, H2AX, PTEN, XRCC4 RBBP8 в 1,9; 2,5; 1,9; 1,7; 1,5 и 2,0 раза соответственно (р<0,05), и снижена копийность генов BCL2, CCND3, TP53 и BAX в 2,6; 2,4; 1,9 и 1,8 раза соответственно (р<0,05) относительно клеток контрольной группы.
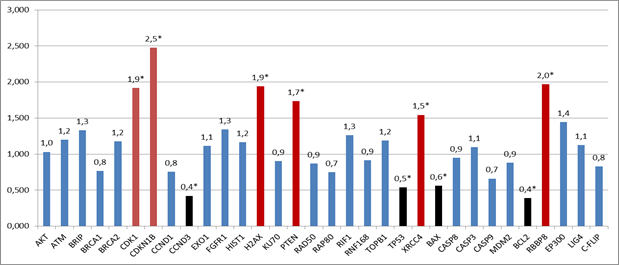
Рис. 3. Относительная копийность генов в клетках PC-3 устойчивых к облучению в дозе 6 Гр в течение 5 дней. * – статистически значимые отличия показателя копийности генов в облученных клетках относительно интактных (р<0,05, тест Newman-Keuls)
В клетках PC-3, подвергнутых облучению 7 Гр, статистически значимо была повышена копийность генов – CDK1, CDKN1B, PTEN, XRCC4, EP300 и RBBP8 в 1,8; 2,6; 1,7; 1,7; 2,0 и 1,7 раза соответственно (р<0,05), при этом была снижена копийность генов CCND3, TP53 и BCL2 в 2,6; 1,8 и 2,4 раза соответственно (р<0,05) относительно клеток контрольной группы (рис. 4).

Рис. 4. Относительная копийность генов в клетках PC-3 устойчивых к облучению в дозе 7 Гр в течение 5 дней. * – статистически значимые отличия показателя копийности генов в облученных клетках относительно интактных (р<0,05, тест Newman-Keuls)
Очевидно на выживаемость клеточных субпопуляций линии PC-3 в условиях облучения копийностью генов AKT, ATM, BRIP, BRCA1, BRCA2, H2AX, RAD50, RAP80, RIF1, RNF168, TOPB1, CASP8, CASP3, CASP9, MDM2, LIG4 и C-FLIP влияние не оказывает (копийность этих генов не отличается в группах – контроль, доза 6 Гр и 7 Гр).
Анализ сигнальных путей, в которых задействованы гены BRCA1, BRCA2, AKT, ATM, BRIP, H2AX, EXO1, CDK1, XRCC4, RAD50, RAP80, RIF1, RNF168, TOPB1, KU70, CDKN1B, CCND1, CCND3, FGFR2, HIST1, RBBP8, EP300, LIG4, C-FLIP, PTEN, TP53, BAX, CASP8, CASP3, CASP9, MDM2 и BCL2 с помощью алгоритма FMD позволил выделить 6 функциональных модулей, которые визуально представлены на рис. 5.
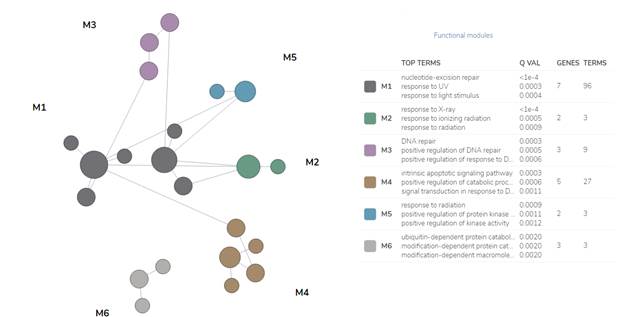
Рис. 5. Функциональная классификация потенциальных предикторов чувствительности опухолевых клеток предстательной железы к ЛТ
Также проведен анализ сети взаимодействия и индекса взаимосвязи генов, изменяющих свою копийность – CDK1, CDKN1B, H2AX, PTEN, XRCC4, BCL2, CCND3, TP53, BAX и RBBP8 (рис. 6). Данные гены являются компонентами различных сигнальных путей нормальных и опухолевых клеток предстательной железы, и изменение показателя их копийности приводит к изменению транскрипционной активности целого ряда других генов [10].
Итак, измененная в определенной субпопуляции клеток копийность генов CDK1, CDKN1B, H2AX, PTEN, XRCC4, BCL2, EP300, CCND3, TP53, BAX и RBBP8, вероятно, обеспечивает повышенную выживаемость опухолевых клеток предстательной железы в условиях лучевой терапии, за счет изменения работы ключевых сигнальных путей обеспечивающих репарацию ДНК, регуляцию апоптоза и клеточного цикла.
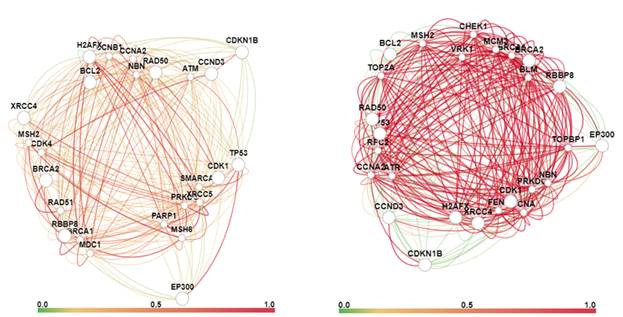
Рис. 6. Сеть взаимодействия и индекс взаимосвязи генов в клетках простаты (слева) и в клетках простаты в условия воздействия ионизирующего излучения (справа). Сеть функциональных взаимодействий указанных выше генов предсказана путем объединения данных полногеномных экспериментов. Узлы представляют гены, а ребра представляют предсказанную вероятность того, что связанные гены участвуют в одном и том же биологическом процессе
Заключение
Таким образом, проведенное исследование позволило установить, что сохранившие после пятидневной лучевой терапии при 6 и 7 Гр жизнеспособность клетки линии PC-3 обладают особыми генетическими характеристиками, собственно, и обеспечивающими их выживание: повышенной копийностью генов CDK1, CDKN1B, H2AX, PTEN, XRCC4, RBBP8 и EP300 и сниженной копийностью CCND3, BAX, TP53 и BCL2. Данные генетические локусы можно рассматривать как наиболее значимые молекулярные предикторы радиорезистентности клеток предстательной железы и можно рекомендовать определение показателя их копийности к апробации в клинической практике.
Исследование выполнено в рамках госзадания «Поиск молекулярно-генетических предикторов радиорезистентного рака предстательной железы и разработка персонифицированных терапевтических подходов».



