Тромбоэмболия легочной артерии (ТЭЛА) – клиническое состояние, обусловленное острой окклюзией артерий малого круга кровообращения тромбоэмболами, мигрировавшими из вен большого круга. В англоязычной литературе привычным является термин pulmonary embolism, включающий помимо ТЭЛА и воздушные, жировые, тканевые эмболии, эмболии амниотической жидкостью.
ТЭЛА была и остается одним из наиболее актуальных и грозных осложнений у пациентов многопрофильного стационара вне зависимости от специфики конкретных отделений [1; 2] и является одной из основных причин внезапной смерти пациентов в стационаре [3].
Частота встречаемости ТЭЛА, по оценкам разных авторов, варьируется от 30 до 100 случаев на 100 тыс. населения в год. Среди пациентов, находящихся на стационарном лечении, этот показатель выше и составляет от 1 до 30%. Летальность от ТЭЛА при отсутствии лечения превышает 30%, и даже при адекватной и своевременно начатой терапии колеблется от 2 до 17%.
С патологоанатомической точки зрения ТЭЛА классифицируется в соответствии с объемом поражения, локализацией тромбоэмбола в сосудистом русле на массивную (обструкция 50% и более сосудистого русла), субмассивную (30-50%) и немассивную (менее 30%). Эта классификация удобна и с точки зрения патофизиологических изменений, возникающих при ТЭЛА, о чем будет написано далее.
С клинической точки зрения адекватной является классификация ТЭЛА по тяжести и степени риска ранней смерти (в первые 30 дней): ТЭЛА высокого риска (ранняя смертность более 15%), промежуточного риска (1-15%, делится на промежуточно-высокого и промежуточно-низкого риска), низкого риска (ранняя смертность менее 1%) [4].
Цель данной работы – определение основных клинически важных патогенетических особенностей тромбоэмболии легочной артерии для оценки эффективности профилактических мероприятий.
Этиология
Этиология ТЭЛА неразрывно связана с тромбозом глубоких вен (ТГВ) нижних конечностей и таза. Причины тромбоза, в свою очередь, соотносятся с триадой Вирхова: повреждение сосудистой стенки, нарушения системы гемостаза в сторону гиперкоагуляции, изменения кровотока (стаз, турбулентный ток крови).
Существует ряд факторов риска тромбофилии, к которым относятся гипергомоцистеинемия, врожденные дефициты протеинов С и S, антитромбина, лейденская мутация V фактора свертывания крови, мутация протромбина 20210А и многие другие. Выявление этих факторов необходимо в подозрительных случаях развития ТЭЛА у молодых пациентов [5].
Врожденные тромбофилии, несмотря на малую частоту встречаемости, могут обеспечивать очень высокий риск развития ТЭЛА у молодых пациентов без дополнительных факторов риска, а также эпизоды повторной ТЭЛА.
Протеин С – основной физиологический антикоагулянт, относится витамин К-зависимым протеолитическим ферментам, активируется под действием тромбина. Протеин S является кофактором для протеин С-опосредованного расщепления факторов Vа и VIIIа. Врожденные дефициты протеинов С и S у гомозигот и двойных гетерозигот приводят к развитию молниеносной неонатальной пурпуры – тяжелой форме неонатального ДВС-синдрома.
Замена аргинина на глутамин в положении 506 в структуре V фактора свертывания делает его невосприимчивым к активированному протеину С. Данная мутация, описанная и молекулярно расшифрованная в 1993 г. в Лейдене, именуется «лейденской».
Высокий уровень протромбина, как одного из главных компонентов свертывающей системы, также способствует развитию тромбозов. Повышенная экспрессия гена протромбина F2, обусловленная заменой гуанина на аденин в положении 20210, вызывает значимую гиперпротромбинемию.
С другой стороны, высокая активность тромбина может поддерживаться за счет инактивации тромбомодулина (например, при гипергомоцистеинемии или системном атеросклерозе), который, связываясь с молекулой тромбина, ускоряет его инактивацию антитромбином III и образует комплекс, активирующий протеин С.
Сложно и многообразно представляется патогенез тромбозов при антифосфолипидном синдроме: прямое ингибирование протеина С; повреждение и/или апоптоз клеток эндотелия, сопровождающееся высвобождением большого количества тканевого фактора; избирательное вытеснение с поверхности мембран эндотелиоцитов аннексинов А2 и А5, предотвращающих активацию коагуляции, что приводит к высокой секреции тканевого фактора в кровоток и развитию тромбозов.
Не меньший вклад в тромбообразование вносит нарушение венозного оттока: варикозное расширение вен, сдавление кистами, опухолями, увеличенной маткой у беременных. Иммобилизация конечностей, связанная с лечебными манипуляциями или ввиду паралича, препятствует адекватной деятельности мышечной помпы и способствует венозному застою.
Любые оперативные вмешательства способствуют повышению риска тромбоэмболических осложнений, в том числе и эндоскопические операции, проводимые на фоне пневмоперитонеума (увеличивается давление в системе полых вен, что уменьшает венозный отток от нижних конечностей).
Существует доказанная связь между онкологическими заболеваниями и высоким риском тромбофилии. Наиболее высокий риск тромбоэмболических осложнений при онкогематологических заболеваниях, раке легких, опухолях желудочно-кишечного тракта, поджелудочной железы. Кроме того, химиотерапия и хирургическое лечение дополнительно увеличивают риск тромбоэмболических осложнений. Имеются данные о резком повышении смертности от ТЭЛА у пациентов с онкозаболеваниями, в сравнении с пациентами без таковых [6].
Тяжелое состояние пациента как само по себе, так и проводимая интенсивная терапия, и это доказано, увеличивают риск ТЭЛА. Пациенты с сепсисом, декомпенсацией дыхательной или сердечной недостаточности, выраженным неврологическим дефицитом, а нередко и с их сочетанием составляют до 80% всех летальных случаев ТЭЛА в многопрофильном стационаре.
Патогенез и патологическая анатомия
Патогенез изменений, происходящих у пациента при ТЭЛА, связан с гемодинамическими и респираторными последствиями [7].
При массивной ТЭЛА гемодинамические изменения протекают по типу острой правожелудочковой недостаточности. В результате внезапной окклюзии происходит резкое повышение сопротивления легочных сосудов (увеличивает постнагрузку), что ведет к дилатации правого желудочка (ПЖ). Активация механизма Франка – Старлинга приводит к увеличению времени сокращения ПЖ, в то же время нейрогуморальная регуляция оказывает положительное инотропное и хронотропное действие на сердце. Повышение давления в легочной артерии временно способствует стабилизации кровотока по малому кругу и до известной степени поддерживает адекватное системное артериальное давление. Дальнейшая дилатация ПЖ все увеличивает время сокращения. Когда период его сокращения приходится и на диастолу левого желудочка (ЛЖ), возникает выбухание межжелудочковой перегородки в полость ЛЖ, резко снижая сердечный выброс и обуславливая системную гипотензию. В то же время максимально создаваемое ПЖ давление в легочной артерии не превышает 40 мм рт. ст. ввиду низкой массы миокарда, то есть кровоток по малому кругу не обеспечивает должного возврата в левое сердце, порочный круг замыкается. Высокая потребность ПЖ в кислороде при максимальной нагрузке быстро приводит к ишемизации и снижению и без того низкой сократимости. Системная артериальная гипотензия способствует уменьшению коронарного кровотока, замыкая очередной порочный круг.
Респираторные изменения при ТЭЛА первично обусловлены несоответствием вентиляционно-перфузионных соотношений, когда часть сосудов механически перекрыты и малокровны (функциональное мертвое пространство), часть же – перегружены потоком, что в любом случае ведет к артериальной гипоксемии. С учетом низкого сердечного выброса возникает и венозная гипоксемия. Дополнительно легочно-сердечное шунтирование вследствие открытия анастомозов малого и большого кругов кровообращения еще более усугубляет перфузию легких.
Основные звенья патогенеза нарушений при массивной ТЭЛА представлены на рис. 1.
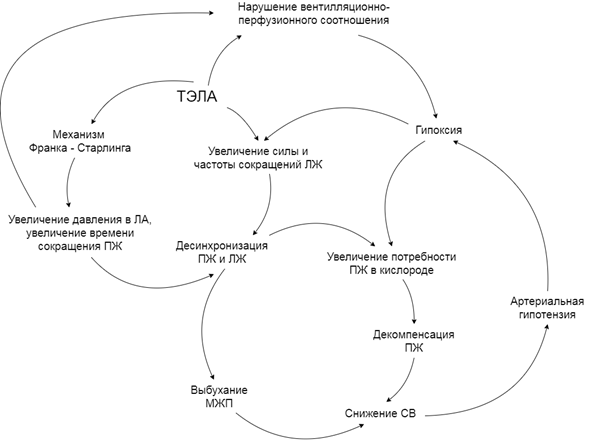
Рис. 1. Основные звенья патогенеза массивной ТЭЛА. ПЖ – правый желудочек.
ЛЖ – левый желудочек. ЛА – легочная артерия. МЖП – межжелудочковая перегородка.
СВ – сердечный выброс
Макроскопическим субстратом массивной ТЭЛА является обнаружение в легочном стволе, правой или левой легочных артерий тромбоэмболов с характерным видом – суховатые. Крошащиеся тромботические массы, не связанные с сосудистой стенкой, отличные от гладких, повторяющих форму сосудов посмертных сгустков (рис. 2).
При субмассивной ТЭЛА активируются сходные механизмы, однако не столь значительное повышение давления в легочной артерии приводит к дисфункции ПЖ, но не нарушает системную гемодинамику. Клинически выявляются одышка, боли в грудной клетке плевритического характера, синкопе, кровохарканье. Рентгенологически выявляют субплевральное затемнение, которое ошибочно интерпретируют как инфаркт легкого. Следует понимать, что морфологически инфаркт развивается на протяжении некоторого времени, а до момента некроза легочной паренхимы гистологически можно обнаружить альвеолярные кровоизлияния.
В клинической картине и патогенезе немассивной ТЭЛА (мелких ветвей) на первое место выходят местные симптомы и легочные изменения, не редкость и бессимптомное течение. Классическим проявлением является находка конусовидной формы участка геморрагического инфаркта легкого, основанием обращенного к плевре на патологоанатомическом вскрытии, с соответствующей картиной при гистологическом исследовании (рис. 3).
Если ТЭЛА мелких ветвей развивается у тяжелых пациентов, нередко можно наблюдать наслоение картины геморрагического инфаркта и вторичной гипостатической бронхопневмонии (рис. 4).
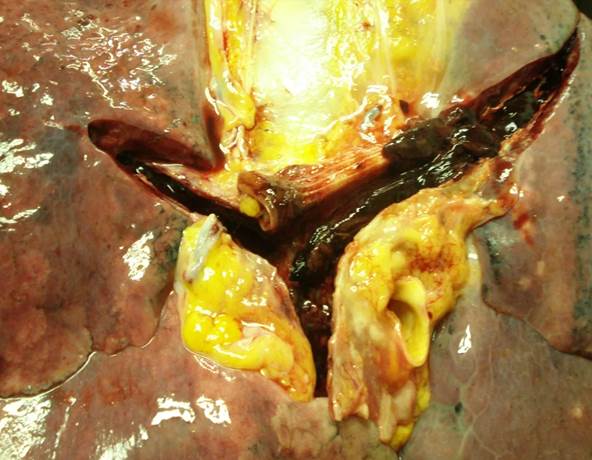
Рис. 2. ТЭЛА. Вскрытый легочный ствол, правая и левая легочные артерии, в просвете – тромбоэмбол
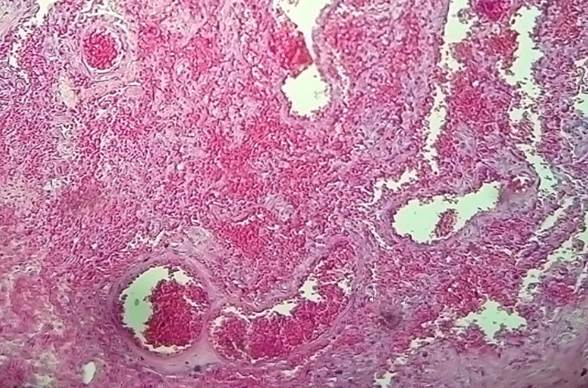
Рис. 3. Микропрепарат. Геморрагический инфаркт легкого, в просвете сосудов – тромботические массы. Окраска – гематоксилин, эозин. Увеличение х80
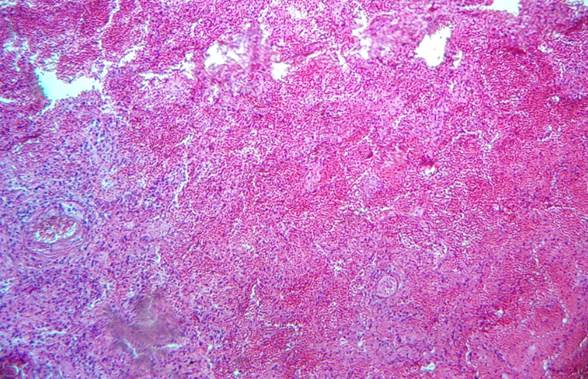
Рис. 4. Микропрепарат. Геморрагический инфаркт легкого и гипостатическая пневмония. Слева – в просвете альвеол полиморфноядерные лейкоциты. Окраска – гематоксилин, эозин. Увеличение х50
Статистический анализ
В ходе работы мы проанализировали 168 историй болезни пациентов с установленным диагнозом ТЭЛА как непосредственной причины смерти по результатам аутопсии в ГБУЗ «СГКБ № 1 им. Н.И. Пирогова» за 2012-2019 гг. Пациенты хирургических отделений составили 63% (106 человек), неврологического – 34% (57 человек), гинекологического – 2% (4 человека), нейрохирургического – менее 1% (1 человек). Средний возраст пациентов составил 64.3 ± 5.5 года. Соотношение мужчин и женщин – 1 : 1.2.
Исходя из распределения частоты случаев по профилям отделений, можно сказать, что хирургические вмешательства, будучи однозначно доказанным фактором риска, обеспечивают подавляющее большинство случаем ТЭЛА в многопрофильном стационаре [8].
Иммобилизация, характерная и для хирургических больных, является важным фактором возникновения ТЭЛА у пациентов неврологического профиля, особенно из отделения для больных с острыми нарушениями мозгового кровообращения.
В ходе ретроспективного анализа было установлено, что у пациентов группы высокого риска менее чем в половине (38%) случаев анализируют состояние свертывающей системы крови, и менее чем в каждом четвертом (23%) определяют наличие тромбоза глубоких вен.
Незнание ключевых позиций патогенеза ТЭЛА объясняет, видимо, недостаточную эффективность профилактики: в 27% случаев в историях болезни не отражено наличие риска тромбоэмболических осложнений, не назначено никаких профилактических мероприятий. В 21% случаев оцененный высокий риск ТЭЛА не сопровождался последующим назначением профилактической терапии.
Выводы
Современные представления об этиологии, патогенезе и клинической картине ТЭЛА многообразны, представлены клиническими случаями, обзорами литературы, статистическими обзорами. Большинство этих концепций находят свое применение в клинических рекомендациях и протоколах ведения больных.
К сожалению, несмотря на всестороннюю освещенность вопроса, смертность от тромбоэмболических осложнений остается весьма высокой, а мероприятия, направленные на их профилактику – малоэффективными, а зачастую – игнорируются.



