Современная стратегия Всемирной организации здравоохранения (ВОЗ) по ликвидации туберкулеза содержит три базовых элемента, первым из которых является пациент-ориентированный подход к лечению туберкулеза. В 2018 г. опубликован Сборник руководящих принципов и стандартов ВОЗ: обеспечение оптимального оказания медицинских услуг пациентам с туберкулезом (второе издание) [1]. Настоящий документ посвящен первому базовому элементу Стратегии ВОЗ по ликвидации туберкулеза, т.е. мероприятиям, связанным с комплексным лечением и профилактикой туберкулеза, в целях ранней диагностики, лечения и оказания медицинской помощи всем пациентам, включая детей.
Для лечения туберкулеза с подтвержденной или предполагаемой лекарственной чувствительностью возбудителя применяют препараты первого ряда: изониазид (H), рифампицин (R), пиразинамид (Z), этамбутол (E), а более удобной для применения формой могут быть комбинированные противотуберкулезные препараты с фиксированными дозировками (КПФД), особенно в детском возрасте.
Применение КПФД с детскими дозировками по первому и третьему режиму химиотерапии прописано и в обновленных национальных клинических рекомендациях [2].
Многочисленные исследования свидетельствуют о том, что КПФД не уступают отдельным лекарственным формам противотуберкулезных препаратов в плане эффективности по таким показателям, как результативность лечения, приверженность лечению и нежелательные явления, о чем мы ранее писали в обзоре доступных публикаций по применению комбинированных препаратов [3]. Использование у детей КПФД (желательно в виде сиропов, жевательных и диспергируемых форм) помогает существенно упростить способ введения противотуберкулезных препаратов [4], снизить психоэмоциональную нагрузку за счет сокращения числа принимаемых таблеток пациентом, тем самым обеспечивая более высокую комплаентность [3, 5].
Одним из важных факторов при лечении больных туберкулезом является биодоступность противотуберкулезных препаратов.
Биодоступность лекарственных средств служит одним из существенных параметров, применяемых в фармакокинетике. Биодоступность в широком смысле – это доля лекарственного вещества, доходящая до места его действия в организме человека (способность препарата усваиваться), т.е., чем выше биодоступность лекарственного вещества, тем меньше его потерь будет при использовании организмом [6].
Для изучения биодоступности (БД) лекарственных средств используют различные методы. Чаще всего проводят сравнительное изучение изменений концентраций лекарственного вещества в исследуемой и стандартной лекарственных формах в плазме крови и/или в моче. На БД лекарственных средств влияет масса различных факторов, в том числе возраст, пути введения препарата, прием пищи до и после введения препарата.
Фармакокинетические исследования противотуберкулезных препаратов у детей за последнее десятилетие показали, что дети младшего возраста имеют более низкий уровень максимальной концентрации противотуберкулезных препаратов первого ряда, чем дети старшего возраста или взрослые пациенты [7–10]. Однако в этих публикациях не приводятся данные по изучению биодоступности этих препаратов в комбинированных формах.
Из немногочисленных исследований известно, что биодоступность рифампицина в КПФД у детей по сравнению со взрослыми относительно низкая и до достижения желаемой концентрации необходимо увеличение дозы рифампицина до 15 мг/кг [11–13].
Цель исследования: изучить особенности фармакокинетики рифампицина и изониазида в составе комбинированного препарата с фиксированной дозой (H 150 мг + Z 375 мг + R 150 мг) для лечения лекарственно-чувствительного туберкулеза у детей.
Материалы и методы исследования
Проведено сравнительное исследование фармакокинетики рифампицина и изониазида (как наиболее активных противотуберкулезных препаратов для лечения лекарственно-чувствительного туберкулеза) в виде монопрепаратов и в составе КПФД (H 150 мг + Z 375 мг + R 150 мг).
В исследование были включены 22 пациента с впервые выявленным туберкулезом органов дыхания с установленной или предполагаемой чувствительностью микобактерий туберкулеза к противотуберкулезным препаратам первого ряда в возрасте от 2 до 17 лет включительно. Все пациенты получили назначение на лечение по первому (I) или третьему (III) режиму химиотерапии. Пациенты условно были разделены на основную и контрольную группы.
Основную группу составили 11 детей, которые получали КПФД в растворимой форме (растворяли в 50–100 мл воды). Препарат дети принимали утром натощак за 30 мин до еды, поскольку биодоступность рифампицина (основного препарата первого ряда) снижается при приеме с пищей (инструкция к препарату grls.rosminzdrav.ru, Регистрационное удостоверение ЛП-001810, 2012.). Дозировку (количество таблеток) рассчитывали по рифампицину, 10 мг/кг массы тела ребенка, но не более 0,6 суточной дозы. Для формирования полного режима химиотерапии четвертым препаратом назначали этамбутол (E). В редких случаях, при противопоказаниях к применению этамбутола, назначали амикацин (Am) внутримышечно.
Контрольную группу составили 11 пациентов, которые в соответствии с I или III режимом химиотерапии получали противотуберкулезные препараты первого ряда изониазид (H), рифампицин (R), пиразинамид (Z), этамбутол (E), а при противопоказаниях к этамбутолу – амикацин (Am) внутримышечно. В этой группе препараты дети принимали раздельно по времени. Так, изониазид дети получали после приема пищи, а рифампицин – до приема пищи.
В исследование не входили больные туберкулезом с установленной или предположительной (из контакта) лекарственной устойчивостью МБТ к противотуберкулезным препаратам.
Основная и контрольная группы были сопоставимы по возрасту, полу, клинико-рентгенологическим данным.
Забор венозной крови (4 мл) для фармакокинетического анализа производили у пациентов обеих групп до приема препаратов (в первую очередь интересовала концентрация рифампицина), а также через 2, 4, 24 ч после приема препаратов. Образцы крови центрифугировали в течение 20 мин при 2500 об/мин. Полученную сыворотку замораживали при температуре –30оС и далее перевозили в сумке-холодильнике в Федеральный исследовательский центр Биотехнологии РАН.
В ФИЦ Биотехнологии РАН использовали изониазид фирмы Sigma-Aldrichкат. номер I-3377 и рифампицин фирмы Sigma-Aldrichкат. номер R-7382. Стоковые растворы с концентрацией 1 мг/мл готовили растворением навески изониазида в 50%-ном метаноле, а навески рифампицина – в 100%-ном метаноле. Стоковые растворы хранили при температуре –800С. Промежуточные растворы с концентрацией 100 мкг/мл хранили в морозильной камере при температуре –200С не более 1 недели.
Для проведения хроматографического анализа пробоподготовку опытных образцов сыворотки крови человека проводили следующим образом: к 100 мкл сыворотки добавляли 200 мкл ацетонитрила, встряхивали на вортексе 30 с и через 5 мин добавляли 500 мкл 50%-ного раствора метанола. Снова встряхивали и через 5 мин центрифугировали 10 мин при 14000 об/мин и температуре ротора +50С. Затем 200 мкл супернатанта переносили в виалу для дальнейшего хроматографического анализа.
Для определения концентраций таргетных антибиотиков в сыворотке крови пациентов использовали комбинацию хроматографического комплекса, состоящего из бинарного насоса Agilent Infinity 1290 BinPump, диодно-матричного детектора 1290 DAD, колоночного термостата 1290 TTC и автосамплера 1290 Sampler, и тройного квадрупольного детектора 6460 Triple Quad LC/MS фирмы Agilent. Для разделения использовали колонку фирмы Agilent SB-C18 диаметром 2,1 мм, длиной 10 см и размером частиц неподвижной фазы 3 мкм.
Параметры проведения анализа: автосамплер – объем вводимой пробы 5 мкл, с 3-секундной промывкой иглы 10%-ным водным раствором ацетонитрила для уменьшения эффекта переноса. Температура при анализе проб – 60С. Колоночный термостат – температура 300С. Диодно-матричный детектор – длина волны 263 нм при ширине щели 4 нм. Сканирование спектра поглощения в диапазоне от 190 до 400 нм. Бинарный насос: в качестве подвижной фазы А использовали метанол с 0,1% муравьиной кислоты, в качестве подвижной фазы В – деионизированную воду с 0,1% муравьиной кислоты.
Приготовление стандартных растворов
Использовали изониазид фирмы Sigma-Aldrich кат. номер I -3377 и рифампицин той же фирмы кат. номер R-7382.
Стоковые растворы с концентрацией 1 мг/мл готовили растворением навески изониазида в 50%-ном метаноле, а навески рифампицина – в 100%-ном метаноле. Стоковые растворы хранили при температуре –800С. Промежуточные растворы с концентрацией 100 мкг/мл хранили в морозильной камере при температуре –200С не более 1 недели.
Для калибровки использовали следующий диапазон по концентрации.
- Изониазид – 0,25 мкг/мл Рифампицин – 2,5 мг/мл.
- Изониазид – 0, 5 мкг/мл Рифампицин –5 мг/мл.
- Изониазид – 0,75 мкг/мл Рифампицин – 7,5 мг/мл.
- Изониазид – 1 мкг/мл Рифампицин – 10 мг/мл.
- Изониазид – 1,25 мкг/мл Рифампицин – 12,5 мг/мл.
Калибровочные стандарты готовили следующим образом: к 100 мкл контрольной сыворотки крови человека добавляли необходимое количество промежуточного раствора изониазида и рифампицина, встряхивали на вортексе 30 с и через 5 мин добавляли 10 мкл ацетонитрила. Снова перемешивали на вортексе и через 5 мин добавляли 50%-ный раствор метанола до конечного объема 1000 мкл. После этого полученные пробы центрифугировали 10 мин при 14000 об/мин. Супернатант переносили в виалу для дальнейшего хроматографического анализа.
Проведение хроматографического анализа
Пробоподготовку опытных образцов сыворотки крови человека проводили следующим образом: к 100 мкл сыворотки добавляли 200 мкл ацетонитрила, встряхивали на вортексе 30 с и через 5 мин добавляли 500 мкл 50%-ного раствора метанола. Снова встряхивали и через 5 мин центрифугировали 10 мин при 14000 об/мин. Затем 200 мкл супернатанта переносили в виалу для дальнейшего хроматографического анализа.
Для определения концентраций таргетных антибиотиков в сыворотке крови пациентов использовали комбинацию хроматографического комплекса, состоящего из бинарного насоса Agilent Infinity 1290 Bin Pump, диодно-матричного детектора 1290 DAD, колоночного термостата 1290 TTC и автосамплера 1290 Sampler, и тройного квадруполного детектора 6460 Triple Quad LC/MS фирмы Agilent.
Для разделения использовали колонку фирмы Agilent SB-C18 диаметром 2,1 мм, длиной 10 см и размером частиц неподвижной фазы 3 мкм.
Параметры проведения анализа
Автосамплер – объем вводимой пробы 5 мкл, с 3-секундной промывкой иглы 10%-ным водным раствором ацетонитрила для уменьшения эффекта переноса. Температура при анализе проб –60С.
Колоночный термостат – температура 300С.
Диодно-матричный детектор – длина волны 263 нм при ширине щели 4 нм. Сканирование спектра поглощения в диапазоне от 190 до 400 нм.
Бинарный насос – в качестве подвижной фазы А использовали метанол с 0,1% муравьиной кислоты, в качестве подвижной фазы В использовали деионизованную воду с 0,1% муравьиной кислоты.
|
Время (мин) |
А (%) |
В (%) |
Скорость (мл/мин) |
|
0 |
60 |
40 |
0,15 |
|
1 |
60 |
40 |
0,15 |
|
2,3 |
80 |
20 |
0,4 |
|
3 |
80 |
20 |
0,4 |
|
4 |
60 |
40 |
0,15 |
После завершения градиента колонка дополнительно уравновешивалась, как указано в таблице для нулевой точки градиента.
Параметры масс-детектора
Источник ионов – AJS ESI (Agilent Jet Stream Electo spray ionization) с положительной полярностью.
Основной газ – азот
Основной поток газа – 5 л/мин при температуре - 3000С
Вспомогательный поток газа – 10 л/мин при температуре - 3500С
Давление на небулизере – 30 psi
Напряжение на капилляре – 3500 В
Напряжение на форсунке – 500 В
Collision gas – аргон при давлении 20 psi
Для масс-спектрометрического определения концентрации таргетных антибиотиков использовали метод MRM (multi reaction мониторинг) со следующими настройками.
Изониазид определяли при положительной полярности по переходу массы 138,1 в 121,1 при напряжении на фрагментаторе 100 В, Collision Energy – 8, напряжении на акцелераторе 4 В.
Рифампицин определяли при положительной полярности по переходу массы 824 в 792,5 при напряжении на фрагментаторе 100 В, Collision Energy – 13, напряжении на акцелераторе 4 В.
Статистическую обработку результатов осуществляли с использованием среды для статистических вычислений R версии 3.6.0. (R Foundation for Statistical Computing, Вена, Австрия). Графики и построение моделей кинетики препаратов производили в Excel 10.0. При оценке результатов статистически значимыми считали результаты при значениях р<0,05. Расчет фармакокинетических данных осуществляли с использованием следующих параметров.
- AUC (area under the curve) площадь под кривой – площадь фигуры, образованной кривой значений концентрации препарата в сыворотке крови в течение суток, ограниченной осями координат (АUC = Co/Kel).
- Tmax – время достижения максимальной концентрации лекарственного вещества в сыворотке крови.
- Cmax – максимальное значение концентрации лекарственного вещества в сыворотке крови.
- Т½ период полувыведения – время, за которое сывороточная концентрация вещества снижается вдвое.
- Кel константа скорости элиминации – доля уменьшения концентрации лекарственного вещества в сыворотке крови за единицу времени.
- Ка константа скорости абсорбции (всасывания) – доля увеличения концентрации лекарственного вещества в сыворотке крови за единицу времени; характеризует скорость всасывания лекарственного вещества в организме человека.
- Расчет фармакокинетических параметров проводили исходя из монокомпартментной модели поведения лекарственных препаратов.
Результаты исследования и их обсуждение
В ходе исследования средняя концентрация изониазида в крови детей в основной группе (комбинированные препараты) через 2 ч составила 1,71±1,51 μg/ml, а в контрольной группе (монопрепараты) – 0,79±0,89 μg/ml. Через 4 ч средняя концентрация Н составила в основной группе 1,07±0,62, а в контрольной группе – 1,67±1,18 μg/ml (рис. 1). Сравнение значений концентрации Н в основной и контрольной группах выявило достоверные различия достигнутых концентраций как на 2-м, так и на 4-м часу (р=0,04). По-видимому, эти различия связаны с тем, что прием КПФД (H 150 мг + Z 375 мг + R 150 мг) в основной группе осуществлялся натощак за 30 мин до приема пищи, в отличие от контрольной группы, где H получали после приема пищи, в то время как кровь собиралась в точках времени от начала приема рифампицина (т.е. до приема пищи).
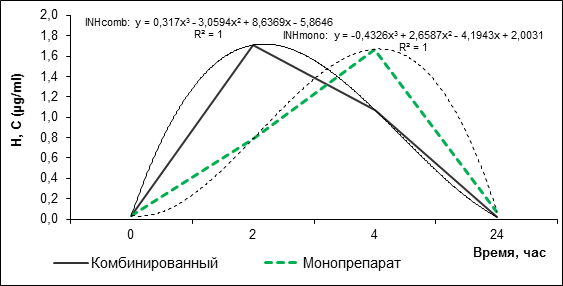
Рис. 1. Динамика концентрации изониазида в сыворотке крови после его приема в виде монопрепарата и изониазида в составе КПФД
Достоверные различия были выявлены при расчете периода полувыведения, константы элиминации, где р=0,001, а также константы скорости абсорбции (последнее также объясняется отсроченным приемом препарата в контрольной группе). Однако площади под фармакокинетической кривой оказались близкими, не выходящими за рамки статистической погрешности. По остальным параметрам, максимальной концентрации препарата, времени достижения максимальной концентрации лекарственного вещества, несмотря на некоторое различие в величинах, разница также не является достоверной (табл. 1).
Таблица 1
Фармакокинетические параметры изониазида в виде монопрепарата и изониазида
в составе КПФД
|
Фармакокинетика INH |
Параметр |
Результаты |
Достоверность при р<0,05 |
|
Основная группа |
AUC, мкг/мл*час |
10,28±6,11 |
0,79 |
|
Контрольная группа |
AUC, мкг/мл*час |
13,21±5,29 |
|
|
Основная группа |
Cmax, мкг/мл |
2,05±1,33 |
0,23 |
|
Контрольная группа |
Cmax, мкг/мл |
1,92±1,14 |
|
|
Основная группа |
Tmax, час |
2,66±0,94 |
0,2 |
|
Контрольная группа |
Tmax, час |
3,28±0,95 |
|
|
Основная группа |
Т½, час |
3,39±0,44 |
0,001 |
|
Контрольная группа |
Т½, час |
4,33±0,58 |
|
|
Основная группа |
К-el, час-1 |
0,20±0,02 |
0,001 |
|
Контрольная группа |
К-el, час-1 |
0,16±0,02 |
|
|
Основная группа |
К-а, час-1 |
0,73±0,09 |
0,05 |
|
Контрольная группа |
К-а, час-1 |
0,55±,017 |
Ситуация с изменением концентрации рифампицина иная. Средняя концентрация препарата в крови детей в основной группе через 2 ч составила 13,11±10,626 μg/ml, в контрольной группе – 12,82±9,85 μg/ml, а через 4 ч составила 11,48±6,7 μg/ml в основной группе, в контрольной группе – 7,11±4,37 μg/ml (рис. 2). Достоверные различия концентраций препарата наблюдаются через 4 ч (р=0,03).
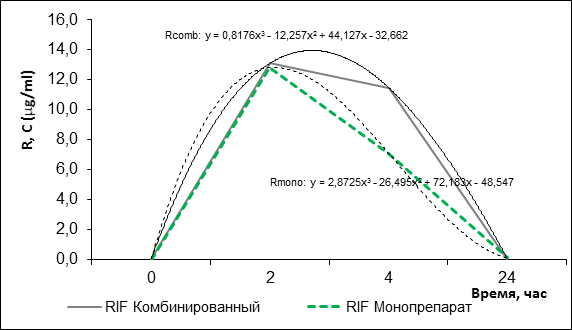
Рис. 2. Динамика концентрации рифампицина в сыворотке крови после его приема в виде монопрепарата и рифампицина в составе КПФД
Рис. 2А. Смоделированная динамика концентрации рифампицина в сыворотке крови одного из пациентов после приема КПФД для оценки фармакокинетических показателей
Однако при расчете параметров, указанных в таблице 2, статистическая погрешность оказалась достаточно большой и достоверных различий отмечено не было, по-видимому, в силу небольшой выборки в группах сравнения.
Таблица 2
Фармакокинетические параметры рифампицина в виде монопрепарата и рифампицина в составе КПФД
|
Фармакокинетика RIF |
Параметр |
Значение |
Достоверность при р<0,05 |
|
Основная группа |
AUC, мкг/мл*час |
83,51±52,73 |
0,23 |
|
Контрольная группа |
AUC, мкг/мл*час |
68,63±28,67 |
|
|
Основная группа |
Cmax, мкг/мл |
14,95±8,82 |
0,46 |
|
Контрольная группа |
Cmax, мкг/мл |
13,72±9,51 |
|
|
Основная группа |
Tmax, час |
2,89±0.99 |
0,28 |
|
Контрольная группа |
Tmax, час |
2,29±0,7 |
|
|
Основная группа |
Т½, час |
2,57±0,39 |
0,98 |
|
Контрольная группа |
Т½, час |
3,15±0,71 |
|
|
Основная группа |
К-el, час-1 |
0,27±0,04 |
0,82 |
|
Контрольная группа |
К-el, час-1 |
0,22±0,04 |
|
|
Основная группа |
К-а, час-1 |
0,94±0,25 |
0,88 |
|
Контрольная группа |
К-а, час-1 |
1,14±0,36 |
При более детальном сравнении исходных данных проявляются некоторые особенности фармакокинетики исследованных препаратов.
Так, пациенты обеих групп были разделены на подгруппы 1 и 2 по отношению к величинам концентраций препаратов, измеренных на 2-м и 4-м часе после приема препаратов.
По рифампицину группа пациентов, принимающих КПФД (H 150 мг + Z 375 мг + R 150 мг), распалась на две подгруппы: быстрых (3 человека: № 7, 8, 9) и медленных (8 человек) ферментаторов по скорости абсорбции (рис. 3). На 95%-уровне значимости различия в средних значениях максимальных концентраций в этих группах не достоверны, однако через 2 ч концентрация в большей группе (быстрых ферментаторов) выше с ошибкой 0,09.
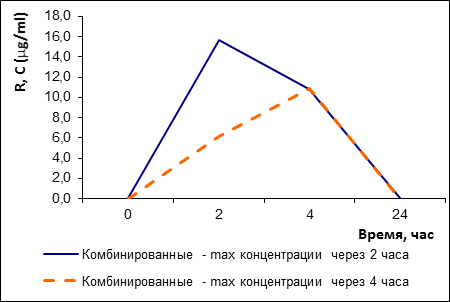
Рис. 3. Быстрые и медленные ферментаторы рифампицина в составе КПФД, динамика концентрации рифампицина в сыворотке крови
Группа пациентов, принимающих рифампицин в виде монопрепарата, также распалась на две подгруппы: на быстрых (2 человека: № 07, 08) и на медленных (9 человек) ферментаторов (рис. 4) также по скорости абсорбции. При этом по скорости абсорбции разница наглядна и сопровождается в том и другом случае более высокими значениями достигнутых максимальных концентраций (p<0,05), а по скорости элиминации препарата разница статистически не достоверна. При этом достоверные различия в разнице достигнутых концентраций выявлены для 2-го часа.
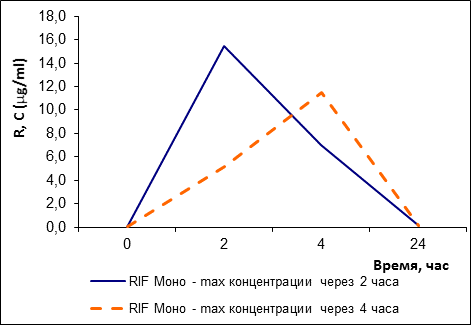
Рис. 4. Динамика концентрации рифампицина в сыворотке крови после его приема в виде монопрепаратов и в комбинированной форме в группах быстрых и медленных ферментаторов рифампицина
Сравнение средних концентраций в сыворотке крови по группам пациентов, принимавших препараты в разных формах на моменты времени 0 ч, 2 ч, 4 ч и 24 ч, проведено с помощью дисперсионного анализа с повторными измерениями. При расчете р-значения при взаимодействии факторов (Group:Time) для быстрых ферментаторов составили 0,74 и для медленных 0,6, что означает отсутствие статистически значимых различий между группами на каждый момент времени. Другими словами, достоверных различий в фармакокинетике исследуемых форм рифампицина не наблюдается.
Таблица 3
Средние концентрации быстрых и медленных ферментаторов монопрепарата и рифампицина в составе КПФД
|
|
0 |
2 |
4 |
24 |
p-значение |
|
Концентрация R в КПФД – быстрые |
0,03 |
15,62 |
10,87 |
0,10 |
0,74 |
|
R-монопрепарат – быстрые |
0,02 |
15,5 |
7,05 |
0,14 |
|
|
Концентрация R в КПФД – медленные |
0,02 |
7,63 |
10,90 |
0,03 |
0,6 |
|
R-монопрепарат – медленные |
0,01 |
5,21 |
11,48 |
0,14 |
По изониазиду группа, принимающая КПФД (H 150 мг + Z 375 мг + R 150 мг), также распалась на быстрых (7 человек – группа 1) и медленных (4 человека – № 2, 6, 8, 9, группа 2) ферментаторов (рис. 5).
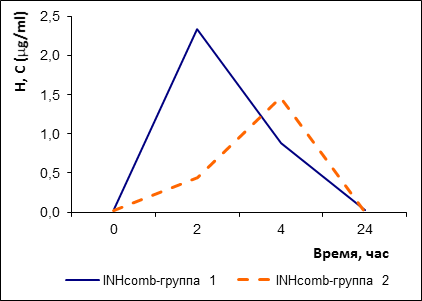
Рис. 5. Фармакокинетические кривые изониазида у быстрых (группа 1) и медленных (группа 2) ферментаторов изониазида в составе КПФД
Группа, принимающая монопрепарат, аналогично распалась на две группы: на быстрых (3 человека: № 01, 03, 06) и медленных (8 человек) ферментаторов (рис. 6).
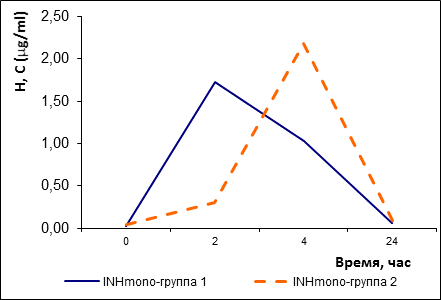
Рис. 6. Фармакокинетические кривые изониазида у быстрых и медленных ферментаторов изониазида в виде монопрепаратов
Аналогичное сравнение средних концентраций в сыворотке крови по группам пациентов, принимавших препараты в разных формах, на моменты времени 0 ч, 2 ч, 4 ч и 24 ч проведено с помощью дисперсионного анализа с повторными измерениями. При расчете р-значение при взаимодействии факторов (Group:Time) составило для быстрых ферментаторов 0,25 и для медленных 0,47, что означает отсутствие статистически значимых различий между группами на каждый момент времени. Другими словами, достоверных различий в фармакокинетике исследуемых форм изониазида не наблюдалось (табл. 4).
Таблица 4
Средние концентрации быстрых и медленных ферментаторов изониазида в виде монопрепарата и изониазида в составе КПФД
|
|
0 |
2 |
4 |
24 |
p-значение |
|
Концентрация Н в КПФД-быстрые |
0,03 |
2,34 |
0,88 |
0,02 |
0,25 |
|
Н-монопрепарат – быстрые |
0,03 |
1,72 |
1,03 |
0,06 |
|
|
Концентрация Н в КПФД – медленные |
0,02 |
0,44 |
1,46 |
0,01 |
0,47 |
|
Н-монопрепарат – медленные |
0,04 |
0,30 |
2,19 |
0,09 |
Клинический пример
Подросток В. 16 лет, из благополучной семьи, впервые обследован в ПТД по месту жительства в сентябре 2018 г. в связи с положительной пробой с АТР от 11.2018 г – пап 11 мм, на КТ ОГК выявлены очаговые изменения на верхушке правого легкого. Госпитализирован в ДТО НМИЦ ФПИ с диагнозом: Очаговый туберкулез С1 правого легкого в фазе инфильтрации, МБТ-. Учитывая, что процесс впервые выявленный, ранее не леченный с сохранением активности, без бактериовыделения и риска МЛУ, назначено лечение по III РХТ: КПФД (H 150 мг + Z 375 мг + R 150 мг) 4 т. х 1 р/д утром натощак (вес 65,7 кг), четвертым препаратом был назначен Е 1,2. В день взятия крови на фармакокинетический анализ пациент отметил жалобы на боли в животе, однократную рвоту. Учитывая вышеизложенные жалобы, была также взята кровь на биохимический анализ по cito. В б/х анализе крови отмечались повышенные трансаминазы, увеличение АЛТ 130 Ед/л, АСТ 151 Ед/л и прямой билирубин 5,3 мкмоль/л. Проведена дезинтоксикационная терапия с положительным эффектом. Однако на полученных хроматограммах плазмы крови после приема КПФД (H 150 мг + Z 375 мг + R 150 мг) видно, что пик R лежит через 2 ч в пределах 22 мкг/мл (R) и H 1,2 мкг/мл (H), находящихся в границах допустимой нормы (рис. 7).
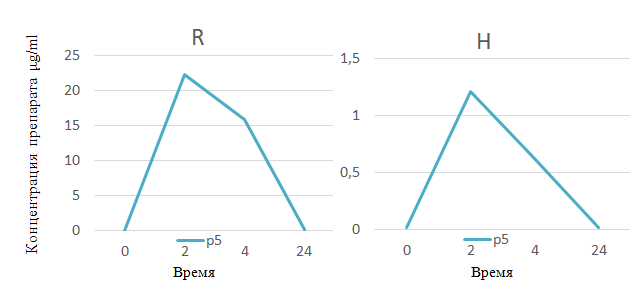
Рис. 7. Хроматограмма плазмы крови пациента В., 16 лет
Стоит отметить, что на полученных хроматограммах плазмы крови была зафиксирована высокая концентрация R через 2 ч – до 34 мкг/мл (рис. 8) у пациента р3 из основной группы; у р05 пациента из контрольной группы концентрация R через 2 ч составила 38 мкг/мл (рис. 9), однако клинико-лабораторных изменений в виде гепатотоксических реакций у пациентов отмечено не было.
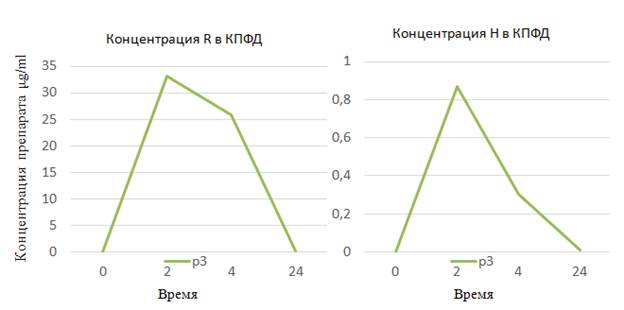
Рис. 8. Хроматограмма плазмы крови пациента p3
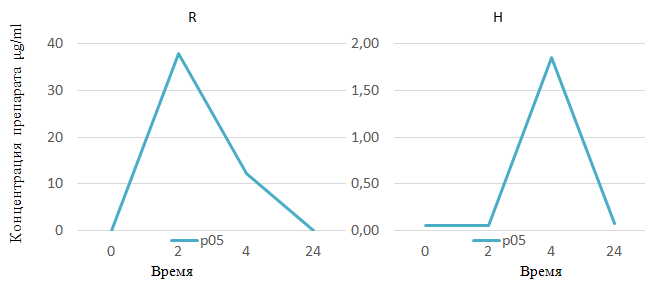
Рис. 9. Хроматограмма плазмы крови пациента p05
Заключение
Одним из факторов, влияющих на биодоступность препарата, является химико-фармацевтический, а именно – форма лекарственного вещества. Возможно, достоверные различия концентраций рифампицина в крови через 4 ч (р=0,03) при приеме диспергируемой комбинированной формы препарата по сравнению с приемом R в виде монопрепарата в комбинации с HZE связаны с формой лекарственного вещества и в определенной степени достоверно превосходят биодоступность рифампицина в виде монопрепарата. Основные фармакокинетические параметры рифампицина в составе КПФД (H 150 мг + Z 375 мг + R 150 мг) и в комбинации с HZE представляются равнозначными.
Учитывая, что отсчет времени для забора крови на фармакокинетический анализ начинался от момента приема КПФД (H 150 мг + Z 375 мг + R 150 мг) и рифампицина в свободной форме, фармакокинетические параметры изониазида в обеих группах показали достоверные различия при расчете периода полувыведения и константе элиминации (р<0,001). Однако показатели площади под фармакокинетической кривой, максимальная концентрация препарата, время достижения максимальной концентрации лекарственного вещества и константа всасывания в обеих группах не показали статистически достоверных различий.
Также не всегда высокая концентрация R влияет на клинико-лабораторные изменения, характерные, например, для гепатотоксических реакций.
Важными преимуществами использования КПФД (H 150 мг + Z 375 мг + R 150 мг) являются не только однократный прием, но и диспергируемая форма препарата.
Можно отметить также, что комбинированные формы препаратов дают меньший разброс в наблюдаемых фармакокинетических параметрах, поэтому их поведение более предсказуемо. Это позволяет более четко отслеживать их и в перспективе пациент-ориентированного подхода оценивать факторы, влияющие на проявление токсичности и безопасности, а также производить оценку эффективности режимов, на которую влияют такие факторы, как биодоступность препаратов, гетерогенность ферментирующих систем биотрансформации лекарственных средств.
Однако это небольшое исследование показывает, что у детей, так же как и у взрослых, проявляется довольно широкая вариабельность основных кинетических параметров не только по изониазиду, о котором довольно много публикаций, но и по рифампицину, по которому доступных сведений не столь много. При этом для последнего препарата критичным оказывается состояние систем, обеспечивающих его биодоступность. Игнорирование этих факторов может вести к тому, что в процессе лечения необходимая лечебная концентрация может создаваться в системном кровотоке на время, не обеспечивающее лечебного эффекта режима в целом.
Список сокращений:
КПФД – комбинированные препараты с фиксированными дозировками
БД – биодоступность
H – изониазид
R – рифампицин
Z – пиразинамид
E – этамбутол
Am – амикацин



