Тератомы – это своеобразная группа новообразований, состоящих из тканевых и органоподобных элементов. Первое упоминание о тератоме средостения принадлежит Rubino в 1810 году, а в отечественной литературе тератому средостения впервые описал А.П. Буйвид в 1889 году. Тератомы средостения - наиболее частые опухоли, состоящие из герминативных клеток, которые не имеют существенных гендерных различий и могут происходить в любом возрасте, однако наиболее часто возникают в возрасте 20-40 лет, составляя около 15% предсредостенных опухолей у взрослых и 25% предсредостенных опухолей у детей. Тератомы составляют вторую по частоте нозологическую форму новообразований средостения – 15,7–23,1% [1; 2], уступая по частоте только неврогенным опухолям. Тератома средостения возникает в результате спонтанного сосудистого развития некоторых стволовых клеток, оставшихся в средостении во время развития примордиального тимуса на эмбриональной стадии. Тератомы часто встречаются вблизи области тимуса [3]. Обычно данные опухоли в своем составе имеют ткани эктодермы, мезодермы, эндодермы [4]. Тератомы подразделяются на зрелые (доброкачественные) и незрелые (злокачественные), что очень важно для определения тактики лечения и оценки прогноза. По встречаемости зрелые/незрелые тератомы соотносятся 10/1 [5].
Цель настоящей работы – обобщить наш опыт лечения данных опухолей и подчеркнуть основные аспекты данной проблемы.
Материал и методы исследования. В данной работе мы представляем опыт лечения 37 пациентов с тератомами средостения, находившихся на лечении в клиниках торакальной хирургии ГБУЗ СО «ПТД», УНИИФ – филиала ФГБУ «НМИЦ ФПИ» Минздрава России и ГБУЗ СО «СООД». Мужчин было 24, женщин – 13. Возраст больных от 16 до 58 лет. Клинические и анамнестические данные у подавляющего большинства пациентов изначально были неспецифическими: утомляемость и потеря веса у 13 пациентов, одышка у 4, субфебрилитет у 6, боль в груди у 4 и умеренная дисфагия у 1 пациента (у ряда больных эти симптомы сочетались). У 15 пациентов клинических проявлений не было, и заболевание было выявлено при профилактической флюорографии. В 4 случаях пробная торакотомия ранее выполнялась в других больницах. У одного пациента 3 года назад опухоль была удалена не полностью также при торакотомии. У 1 пациентки частичная стернотомия и резекция опухоли выполнены 4 года назад в другом городе. Следовательно, в двух последних случаях речь шла о рецидивах опухоли. При компьютерной томографии (КТ) во всех случаях выявлялось дополнительное солидное образование в переднем средостении, а у 17 больных патологическое образование имело массивные размеры, отклоняло сердце с магистральными сосудами и сдавливало легкие вплоть до полного компрессионного ателектаза. Умеренная компрессия трахеи при трахеобронхоскопии определялась у 2 больных. Морфологическая верификация опухоли имелась у всех больных, перенесших ранее хирургические вмешательства, а у остальных пациентов выполнялась биопсия под рентгеном, КТ- или УЗИ- контролем.
Выбор оперативного доступа диктовался преимущественно локализацией, а также размерами опухоли. Если диаметр опухоли не превышал 10 см и медиальный край ее не достигал срединной линии, то выполняли боковую торакотомию с соответствующей стороны. Стернотомия (полная продольная или частичная продольно-поперечная) выполнялась при больших размерах опухоли и при расположении краев опухоли за срединной линией. Мы выполнили полную продольную стернотомию у 19 пациентов и частичную продольно-поперечную стернотомию - у 1 пациента. У одной пациентки, у которой опухоль рецидивировала после предыдущей резекции, нам пришлось выполнить повторную стернотомию. В 17 была предпринята боковая торакотомия. Для оценки кровопотери на разных этапах операции текущая кровопотеря была измерена у 8 человек на трех этапах: выполнение доступа, мобилизация опухоли в средостении и при отделении опухоли от спаек с грудной стенкой и легким. Для фиксации грудины накладывали обычные проволочные швы. Плевральные полости и средостение дренировали.
Обезболивание. Особых соображений по поводу анестезии не было. Применялась стандартная двулегочная вентиляция легких и внутривенная анестезия.
Дополнительное противоопухолевое лечение не применялось в случаях, когда доброкачественная зрелая тератома была подтверждена при морфологическом исследовании удаленной опухоли. Лучевая терапия 50-65 Гр и интенсивная химиотерапия на основе платины проводились пациентам со злокачественными тератомами.
Результаты исследования и их обсуждение. У 34 пациентов опухоль была удалена полностью. При этом в 2 случаях потребовалось удаление верхней доли левого легкого, а у 4 больных – ограниченные атипичные резекции легких, когда опухоль была тесно спаяна с легочной тканью. В 9 случаях потребовалась резекция перикарда. У одного пациента была проведена субтотальная резекция левой стенки перикарда, после чего мы закрыли дефект широким лоскутом париетальной плевры. Истинная опухолевая инвазия соседних анатомических структур при этом была выявлена при морфологическом исследовании лишь у 3 больных с подтвержденной малигнизацией тератомы. У 1 пациента операция была паллиативной из-за инвазии полой вены и предсердия, а у 2 больных радикальная операция оказалась невозможной по той же причине. Морфологическое исследование также выявило у этих двух пациентов злокачественную трансформацию. Операционная кровопотеря варьировала от 230 до 2530 мл (в среднем = 440 мл) и возникла в основном из-за сильно васкуляризированных спаек между опухолью и грудной стенкой. Наиболее сложным и травматичным этапом хирургического вмешательства оказалось рассечение опухоли от спаек с грудной стенкой. Измерение кровопотери на этапах операции показало, что 83% общей кровопотери произошло во время отделения опухоли от грудной стенки. Во всех этих случаях имели место опухоли больших размеров (более 15 см в наибольшем диаметре). Самая крупная опухоль (зрелая тератома) была массой 3,5 кг. В одном случае опухоль располагалась в переднем косто-диафрагмальном синусе и была изначально трактована как внелегочная секвестрация. При торакотомии оказалось, что это зрелая тератома, исходящая из переднего средостения и спустившаяся на длинной (около 20 см) ножке в передний косто-диафрагмальный синус. Послеоперационные осложнения в виде кровотечений случились у 2 (5,4%) больных, причем у одного пациента, где была удалена гигантская незрелая тератома, это было фибринолизное кровотечение объемом 2530 мл. Летальных исходов не было.
По результатам морфологического исследования зрелая тератома подтверждена у 32 пациентов, незрелая – у 5. Отдаленные (от 2 до 7 лет) результаты прослежены у 16 пациентов. Все пациенты, у которых были зрелые тератомы, живы и здоровы. Трое больных, где была малигнизация опухоли, умерли в течение 2 лет, несмотря на адъювантное лечение.
Приводим следующие наблюдения.
Наблюдение 1. Женщина 18 лет. Студентка. Жалоб не предъявляет. При флюорографии и последующей КТ определяется массивное затемнение, исходящее из переднего средостения, пролабирующее в левую плевральную полость (рис. 1а). Средостение смещено вправо. Структура опухоли неоднородна: видны множественные костно-хрящевые включения и кистозные участки (рис. 1б). Операция: полная продольная стернотомия. Опухоль отделена от грудной стенки. Верхняя доля левого легкого в ателектазе. От легкого опухоль отделена швом аппарата ТА-60. Ножка опухоли исходит из переднего средостения и также пересечена после прошивания ТА-60 (рис. 1в). Продолжительность операции 2 часа 15 минут, кровопотеря 530 мл. Гистологически: зрелая тератома (рис. 1г). Послеоперационный период гладкий. Контрольный осмотр через 2 года – здорова.
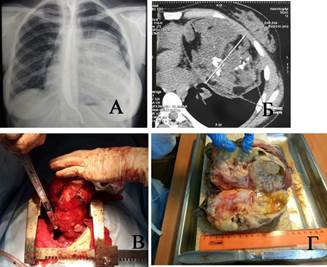
Рис. 1. Наблюдение 1: а) обзорная рентгенограмма пациентки, б) компьютерная томограмма той же больной, в) полная продольная стернотомия, отсечение ножки опухоли, г) опухоль на разрезе – зрелая тератома
Наблюдение 2. Мужчина 24 лет. Строитель. В течение 2 недель стал ощущать слабость, боль в груди, Т >38o, одышку. До этого считал себя здоровым, работал. На КТ определяется массивное солидное гомогенное образование, занимающее практически весь левый гемиторакс и смещающее средостение вправо (рис. 2 а, б). При УЗИ левой плевральной полости определяется жидкость. При плевральной пункции удалено около 2,5 л серозного экссудата. Трансторакальная игловая биопсия: опухолевая ткань, наиболее вероятно герминогенной природы с участками некроза. Операция: полная продольная торакотомия. Опухоль с большими техническими трудностями из-за плотных сращений отделена от грудной стенки. Выделение сопровождалось значительным диффузным кровотечением. Легкое в ателектазе, инвазии его нет. Множественные сосудистые ножки, исходящие из переднего средостения, лигированы и пересечены. Опухоль удалена. Масса опухоли 2,8 кг (рис. 2в). Продолжающееся фибринолизное кровотечение в послеоперационном периоде купировано, кровопотеря возмещена. Дальнейший послеоперационный период без осложнений. При выписке левое легкое полностью расправлено (рис. 2г). Морфологически: незрелая тератома. Далее химиотерапия в режиме ВЕР 4 цикла. Смерть от прогрессирования опухолевого процесса 2 года спустя.
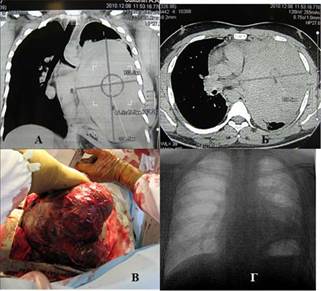
Рис. 2. Наблюдение 2: а, б) компьютерные томограммы пациента, в) полная продольная стернотомия, извлечение препарата, г) обзорная рентгенограмма пациента спустя 7 дней после операции
Клиническая проблема заключается в том, что вначале бессимптомные тератомы переднего средостения могут достигать огромных размеров, но даже при этом симптомы часто бывают неспецифичны. Большинство пациентов с тератомой средостения не имеют явных симптомов, опухоль можно обнаружить лишь при рентгенографии грудной клетки или компьютерной томографии грудной клетки.
Клинические проявления симптоматических пациентов в основном включают: 1. Симптомы связаны с компрессией структуры ткани переднего средостения, вызванной эффектом опухолевой массы, включая стеснение в груди, одышку, массу шеи, синдром верхнего средостения, синдром Хорнера. 2. Симптомы вызваны разрывом опухоли, которая может содержать пищеварительные ферменты, поджелудочной железы, слюнной железы и других тканей, которые действуют на окружающие ткани и проникают в соседние органы, что осложняется плевральным выпотом и гемотораксом, которые в результате вызывают одышку, кровохарканье и обструктивную пневмонию, а также перикардиальный выпот и тампонаду перикарда. У одного из наших пациентов была тупая травма грудной клетки, и гигантская тень изначально была интерпретирована как свернувшийся гемоторакс. Отсюда возникает резонный вопрос: где была профилактическая флюорография? Клинические проявления зрелых тератом у взрослых менее выражены, чем у детей.
Решающая роль в диагностике принадлежит КТ, которая выявляет размеры, локализацию и структуру опухоли. Рентгенография грудной клетки и компьютерная томография могут показать круглую или округлую массу в переднем средостении, частичную дольчатую, кальцификацию в опухоли и даже зуб или кость. Зрелые тератомы - это в основном кистозные массы, в то время как незрелые тератомы - это в основном твердые массы. Большинство тератом средостения расположены в переднем средостении, которые легко ошибочно диагностируются как тимома перед операцией и должны быть тщательно идентифицированы. Однако морфологический диагноз до операции удается получить не всегда.
По нашим данным, игловая биопсия оказалась информативной у 18 больных из 37 (46,4%). Частично этот факт можно объяснить тем, что опухоль имела неоднородную структуру и в значительном большинстве случаев в биоптате преобладали бесструктурные массы, что серьезно затрудняло интерпретацию биоптата.
Вторая проблема - хирургическая. Выбор хирургического метода в основном зависит от локализации, размеров и соотношения опухолевого тела и окружающих тканей. Если опухоль затрагивает средостение билатерально, верхнюю полую вену, внутреннюю вену, сосуды головы и шеи, а начальная часть опухоли неясна, целесообразно выбрать срединную торакотомию для хирургической резекции, когда возможна реконструкция сосудов. Для тех опухолей, у которых опухолевое тело выходит через верхнюю апертуру грудной клетки к шее, Т-образный разрез должен быть сделан через грудину в сочетании с разрезом шейного воротника. При необходимости лобэктомии или клиновидной резекции легкого может быть выбрана заднебоковая торакотомия. При необходимости может быть добавлен боковой разрез грудины с передней торакотомией.
Также может быть использована боковая торакотомия на стороне опухоли. Стоит также отметить, что из-за большой опухоли, обширной адгезии, большой раневой поверхности, неполного расширения легких и остаточной полости в грудной полости и других факторов легко вызвать послеоперационное кровотечение. Следует обратить внимание на защиту диафрагмального нерва, возвратного гортанного нерва, блуждающего нерва и нерва плечевого сплетения, когда опухоль плотно прилегает к поверхности средостения, чтобы избежать серьезных осложнений. В случае если опухоль невозможность удалить полностью, опухолевая ткань должна быть удалена как можно больше, а остаточная кистозная стенка должна быть обработана для уменьшения послеоперационной секреции. Небольшая остаточная опухолевая кистозная стенка в стенке кровеносного сосуда не влияет на прогноз. Непростой аспект операции - выделение опухоли из спаек, на что указывал ряд авторов. На данном этапе операции может развиться тяжелое кровотечение, которое трудно остановить.
Мы также столкнулись с такими проблемами, о чем свидетельствуют наши данные, указанные выше: на данном этапе произошло более 80% общей кровопотери. Развитие таких васкуляризированных спаек можно объяснить длительным медленным ростом опухоли в тесном контакте с париетальной плеврой, перифокальным воспалением. Добавим, что причиной невозможности радикальной операции у 4 наших больных, оперированных ранее, были тяжелые сращения с грудной стенкой, имитирующие инвазию опухоли, и сильное кровотечение при попытках выделения опухоли. Следует подчеркнуть, что мы не обнаружили в таких случаях инвазии опухоли в грудную стенку, а только спайки. На этот факт указывали и другие авторы. Наконец, рассуждая о выборе оперативного доступа, мы можем утверждать, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. Такого же мнения придерживаются ряд отечественных и зарубежных авторов [2; 5].
Заключение. Планируя выбор оперативного доступа, авторы считают, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. И, наконец, онкологическая проблема лечения тератом средостения заключается в отсутствии надежных методов адъювантного лечения, позволяющего остановить опухолевую прогрессию при незрелых тератомах даже в случаях радикального удаления опухоли. Имеющиеся в литературе данные и результаты нашего исследования показали, что прогноз в большинстве таких случаев неблагоприятный, несмотря на последующую химиотерапию и облучение. Химиотерапия на основе платины при незрелых тератомах оставляет надежду на благоприятный прогноз. Однако своевременное обнаружение опухоли на ранней стадии является важнейшим фактором, обеспечивающим удовлетворительный исход лечения.



