Рак яичников занимает восьмое место по смертности среди женских онкозаболеваний. Так, за 2018 год в мировой практике зарегистрировано 295414 новых случаев и 184799 летальных исходов вследствие прогрессирования и последующего рецидивирования злокачественных опухолей яичников [1]. Одной из причин смертности является отсутствие эффективного и чувствительного метода выявления рака яичников на ранних стадиях, мониторинга течения заболевания, прогнозирования возможных рецидивов и прогрессирования опухоли [2; 3]. Современные методы диагностики и прогнозирования рецидивов серозного рака яичников, в том числе уровень CA125 в сыворотке крови, ультрасонография и трансвагинальное ультразвуковое исследование, все еще недостаточно эффективны на ранних стадиях заболевания [4], а во многих случаях не позволяют предсказать агрессивность протекания с последующим летальным исходом [5]. Дополнительные трудности связаны с молекулярно-генетической гетерогенностью злокачественных опухолей на поздних стадиях; в частности, онкогенез серозного рака яичников характеризуется изменением паттернов экспрессии генов и нестабильностью генома [6]. Для улучшения диагностики и мониторинга заболевания необходимо искать новые генетические маркеры, которые могут расширить понимание молекулярных механизмов развития опухоли яичников.
В последнее время стали популярными тесты, основанные на измерении экспрессии малых (длиной 19–22 нуклеотидов) некодирующих РНК, так называемые микроРНК-тесты. микроРНК регулируют экспрессию генов, специфически связываясь с участками генов-мишеней или мРНК [7; 8]. Скрининговые исследования, основанные на анализе микроРНК-транскриптома опухоли, продемонстрировали потенциал микроРНК в ранней диагностике рака яичников и в прогнозировании химиорезистентности опухолевых клеток [9; 10]. Наше исследование было направлено на идентификацию микроРНК-сигнатуры, которая позволит оценить прогноз и осуществлять мониторинг заболевания.
Материал и методы исследования
Дизайн исследования предполагал два этапа. На первом этапе оценивали дифференциальную экспрессию микроРНК по данным TCGA с последующим отбором пула микроРНК, ассоциированных с общей выживаемостью (ОВ). Второй этап предполагал исследование, в которое вошло 87 пациенток с верифицированным диагнозом «серозная карцинома яичников». Возраст больных находился в диапазоне от 24,6 до 76,3 года (53,3 ± 5,4 года). Диагноз в каждом случае был подтвержден гистологически в соответствии с классификацией FIGO (the International Federation of Gynecology and Obstetrics) 2014 года. На данном этапе проводили валидацию результатов анализа TCGA и оценивали перспективы использования выбранных микроРНК в качестве прогностических маркеров. Исследование получило одобрение от этического комитета ФГБУ «НМИЦ онкологии» Минздрава России, все пациентки предоставили добровольные письменные согласия на участие в исследовании.
Анализ данных the Cancer Genome Atlas (TCGA)
На основании данных открытой базы TCGA была сформирована основная группа с серозной цистаденокарциномой яичников (TCGA-OV), в которую были включены 563 опухолевых образца, подвергнутых микрочиповому анализу микроРНК. В качестве образцов сравнения для анализа дифференциально экспрессируемых (ДЭ) микроРНК использовали условно нормальные ткани яичников (n=8): TCGA-01-0631-11A-01T-0364-07, TCGA-01-0633-11A-01T-0364-07, TCGA-01-0637-11A-01T-0364-07, TCGA-01-0630-11A-01T-0364-07, TCGA-01-0628-11A-01T-0364-07, TCGA-01-0639-11A-01T-0364-07, TCGA-01-0636-11A-01T-0364-07, TCGA-01-0642-11A-02T-0364-07. Сбор и обработку данных проводили с помощью вычислительной программной среды R 4.0.2 (пакет TCGABiolinks) [11].
Выделение РНК
Не размораживая, фрагменты опухолевой ткани помещали в TRIzol (ThermoFisher, США) и гомогенизировали с помощью MagNALyser (Roshe, Швейцария). Экстракцию осуществляли согласно рекомендациям производителя TRIzol. Дополнительно очистку препаратов РНК проводили с помощью набора miRNAminiKit (Qiagen, Германия). Полученные образцы суммарной РНК обрабатывали препаратами ДНКазы 1 (ThermoFisher, США) для удаления геномной ДНК. Концентрацию нуклеиновых кислот оценивали на флуориметре Qubit (Thermo Fisher, США) согласно инструкции производителя. Синтез кДНК на РНК-матрице проводили с использованием набора MMLV Reverta («Синтол», Россия).
Анализ экспрессии микроРНК
Оценку относительной экспрессии (RCQ) микроРНК (hsa-miR-140-3p, hsa-miR-150-5p и hsa-miR-221-3p) проводили методом RT-PCR. В качестве референсных локусов использовали микроРНК miR-191-5p, miR-103a-1-5p и малую ядерную РНК RNU49. Стабильность экспрессии оценивали с помощью geNorm [12]. Дизайн специфичных олигонуклеотидных праймеров микроРНК (табл. 1) осуществляли с использованием соответственно Primer-BLAST [13], референсных последовательностей NCBI GenBank и базы данных miRBase [14] по описанному ранее протоколу [15]. ПЦР проводили на приборе Bio-Rad CFX96 (Bio-Rad, США). Анализ данных количественной ПЦР осуществляли методом 2-ΔΔ Сt [16].
Таблица 1
Последовательности праймеров, используемых в исследовании
|
МикроРНК |
Прямой (F) и обратный (R) праймеры для амплификации 5’-3’ |
|
hsa-miR-150-5p |
F: GCAGTCTCCCAACCCTTGTA R: GTCCAGTTTTTTTTTTTTTTTCACTGG |
|
hsa-miR-140-3p |
F: CGCAGTACCACAGGGTAGA R: CCAGTTTTTTTTTTTTTTTCCGTGGT |
|
hsa-miR-221-3p |
F: CGCAGAGCTACATTGTCTGC R: TCCAGTTTTTTTTTTTTTTTGAAACCCA |
|
RT-праймер |
CAGGTCCAGTTTTTTTTTTTTTTTVN (где V — A, C и G; N - A, C, G и T) |
Анализ выживаемости пациенток
С помощью метода Каплана – Мейера отбирали микроРНК, экспрессия которых оказывала значительное влияние на продолжительность ОВ. Экспрессию каждой микроРНК с учетом квантильных точек отсечения (верхняя – 0,7, нижняя – 0,3) подразделяли на низкую, умеренную и высокую. Затем анализировали группы с низкой и высокой экспрессией микроРНК. Отобранные на данном этапе микроРНК подвергали однофакторному и многофакторному анализу Кокса (пакет survutils). Исходя из данных многофакторного регрессионного анализа, рассчитывали risk score для найденной микроРНК-сигнатуры по формуле: risk score = β1 × RCQ miRNA1 + β2 × expression miRNA2+… βn × RCQ miRNAn, где β – коэффициенты многофакторного регрессионного анализа, соответствующие определенным микроРНК. Для оценки прогностических свойств микроРНК-сигнатуры применяли ассоциированный с временем анализ ROC кривых (пакет survivalROC) [17]. Критический уровень значимости при проверке статистических гипотез принимали равным 0.05.
Результаты исследования и их обсуждение
В ходе исследования было обнаружено 126 ДЭ микроРНК, из которых 61 микроРНК отличались сниженной экспрессией и 65 микроРНК – повышенной. Отобрано 33 микроРНК, уровень экспрессии которых был ассоциирован с ОВ пациенток. Среди них обнаружено 3 вирусных микроРНК: ebv-miR-BART19-3p, hiv1-miR-H1, hsv1-miR-H1-5p. По данным однофакторного регрессионного анализа, число микроРНК, опосредующих ОВ, сократилось до 26 (табл. 2). Часть выделенного пула микроРНК (HR<1) обладает протективным эффектом, т.е. повышение их экспрессии связано с увеличением выживаемости; 19 микроРНК (HR>1) реализуют опухолестимулирующий эффект, повышение их экспрессии сопряжено с прогрессированием опухоли и снижением выживаемости.
Таблица 2
Однофакторный и многофакторный анализ микроРНК, ассоциированных с выживаемостью
|
МикроРНК |
Однофакторный анализ |
Многофакторный анализ |
||
|
HR (95% CI) |
p-value |
HR (95% CI) |
p-value |
|
|
ebv-miR-BART19-3p |
1.1 (1-1.3) |
0.0066 |
- |
- |
|
hiv1-miR-H1 |
1.2 (1.1-1.4) |
0.0025 |
- |
- |
|
hsa-let-7b |
1.2 (1-1.4) |
0.017 |
- |
- |
|
hsa-miR-107 |
0.7 (0.57-0.85) |
0.00031 |
- |
- |
|
hsa-miR-139-5p |
1.5 (1-2.1) |
0.041 |
- |
- |
|
hsa-miR-140-3p |
1.3 (1.1-1.6) |
0.003 |
1.6 (1.3-1.9) |
<0.0001 |
|
hsa-miR-148a-3p |
0.82 (0.73-0.92) |
0.00061 |
- |
- |
|
hsa-miR-150-5p |
0.9 (0.81-1) |
0.047 |
0.8 (0.7-0.9) |
0.00022 |
|
hsa-miR-15b-5p |
0.82 (0.72-0.94) |
0.0033 |
|
|
|
hsa-miR-188-5p |
1.2 (1-1.3) |
0.01 |
- |
- |
|
hsa-miR-202-3p |
1.2 (1.1-1.4) |
0.0034 |
- |
- |
|
hsa-miR-214-3p |
1.2 (1-1.3) |
0.008 |
- |
- |
|
hsa-miR-22-3p |
1.2 (1-1.3) |
0.0056 |
- |
- |
|
hsa-miR-221-3p |
1.2 (1.1-1.4) |
0.0027 |
1.3 (1.1-1.5) |
0.001 |
|
hsa-miR-222-3p |
1.2 (1.1-1.4) |
0.0016 |
- |
- |
|
hsa-miR-27a-3p |
1.2 (1-1.4) |
0.026 |
- |
- |
|
hsa-miR-320a-3p |
1.3 (1.1-1.5) |
0.0023 |
- |
- |
|
hsa-miR-363-3p |
0.91 (0.83-0.99) |
0.021 |
- |
- |
|
hsa-miR-374a-5p |
0.84 (0.74-0.96) |
0.01 |
- |
- |
|
hsa-miR-379-5p |
1.2 (1-1.4) |
0.034 |
- |
- |
|
hsa-miR-494-3p |
1.1 (1-1.2) |
0.02 |
- |
- |
|
hsa-miR-572 |
1.2 (1.1-1.4) |
0.0036 |
- |
- |
|
hsa-miR-638 |
1.2 (1-1.3) |
0.0068 |
- |
- |
|
hsa-miR-660-5p |
0.83 (0.71-0.97) |
0.017 |
- |
- |
|
hsa-miR-665 |
1.6 (1.2-2.3) |
0.0024 |
- |
- |
|
hsv1-miR-H1-5p |
1.3 (1.1-1.5) |
0.00034 |
- |
- |
Многофакторный регрессионный анализ позволил идентифицировать прогностическую сигнатуру, состоящую из трех микроРНК: risk score = (0.47 × RCQ hsa-miR-140-3p) + (-0.22 × RCQ hsa-miR-150-5p) + (0.26 × RCQ hsa-miR-221-3p). Показано, что увеличение risk score было связано со снижением ОВ (рис. 1).

Рис. 1. Кривые Каплана-Мейера, отражающие зависимость общей выживаемости от risk score микроРНК-сигнатуры по данным TCGA
Далее полученные результаты были валидированы на опухолевом материале пациенток с Юга России. Медиана risk score для валидационной выборки составила 13, HR - 1.5 (95% CI: 1.22-1.85), p<0.0001. Пациентки были разделены на две группы: группа низкого риска (risk score <13) и группа высокого риска (risk score ≥13). Установлено, что ОВ в группе низкого риска была существенно выше, на 43%, чем в группе высокого риска (p < 0.0001). Тест, основанный на микроРНК-сигнатуре, отличается высокими прогностическими качествами для 2-летней выживаемости: чувствительность и специфичность составили 92% и 98% соответственно (AUC = 0.981; рис. 2).
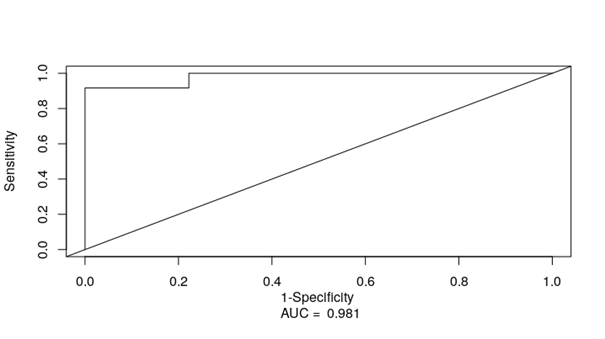
Рис. 2. ROC-анализ прогностических свойств микроРНК-сигнатуры как прогностического показателя для 2-летней выживаемости. AUC - площадь под кривой (area under curve)
В нашем исследовании были определен профиль экспрессии, содержащий 126 микроРНК, характерный для серозного рака яичников. По результатам однофакторного регрессионного анализа удалось выявить взаимосвязь 26 из 125 микроРНК с общей выживаемостью пациенток. Три из 25 микроРНК (hsa-miR-140-3p, hsa-miR-150-5p и hsa-miR-221-3p) вошли в прогностическую сигнатуру, определяющую прогноз течения онкозаболевания.
Нами сделано предположение, согласно которому hsa-miR-140-3p выполняет опухолестимулирующую роль, что выражается в снижении ОВ обратно пропорционально изменению экспрессии маркера (табл. 1). Подтверждением наших выводов служит экспериментальная работа Wang J. и сотрудников [18]. Авторы показали, что hsa-miR-140-3p способна напрямую связываться с MAPK1 и тем самым подавлять цитотоксическую активность NK клеток. В связи с этим возможен беспрепятственный рост опухолевых клеток яичников.
Напротив, hsa-miR-150-5p обладает онкосупрессорными свойствами. Нами установлена прямая зависимость между уровнем данной микроРНК и ОВ (табл. 2). В работе Xia B. и сотрудников показано, что длинная некодирующая РНК ZFAS1 способна подавлять экспрессию hsa-miR-150-5p в опухолевых клетках эпителиального рака яичников. Ось ZFAS1/miR-150-5p/Sp1 обеспечивает пролиферацию и миграцию опухолевых клеток, участвует в развитии химиорезистентности [19]. Позднее была показана связь другой длинной некодирующей РНК MIAT с уровнем hsa-miR-150-5p в клеточных линиях OVCAR3 и SKOV3. Сверхэкспрессия MIAT, сопровождающаяся снижением экспрессии hsa-miR-150-5p, ассоциирована с эпителиально-мезенхимальным переходом, посредством которого реализуется опухолевый рост, миграция и инвазия опухолевых клеток [20].
В настоящем исследовании продемонстрирован онкогенный эффект hsa-miR-221-3p при серозной карциноме яичников (табл. 1), и повышение ее уровня сопряжено со снижением ОВ. По литературным данным, hsa-miR-221-3p перспективна для ранней диагностики рака яичников. Так, тест, основанный на измерении экспрессии hsa-miR-200c-3p и hsa-miR-221-3p в плазме крови, отличается высокой диагностической точностью [21]. Hong F. и сотрудники доказали, что определение уровня hsa-miR-221-3p в сыворотке крови может быть использовано для уточнения стадии заболевания согласно классификации FIGO [22]. Авторы сообщили, что повышенная экспрессия данной микроРНК свидетельствует о неблагоприятном прогнозе [22]. К основным молекулярным механизмам hsa-miR-221-3p относится подавление р53-опосредованного апоптоза с последующей пролиферацией опухолевых клеток [23].
Заключение
Лечение пациенток с серозным раком яичников сопряжено со множеством проблем, начиная от поздней диагностики по причине отсутствия точных маркеров и заканчивая развитием устойчивости к химиотерапии. За последнее 20 лет был достигнут значительный прогресс в понимании вклада микроРНК в механизмы онкогенеза рака яичников. Достижения в данной области могут быть применены для улучшения методов диагностики и прогнозирования рака яичников. Нами была получена прогностическая микроРНК сигнатура, а также 26 микроРНК, ассоциированных с выживаемостью, которые могут быть использованы в мониторинге исследуемой онкопатологии и оценке прогноза заболевания. Результаты нашего исследования имеют практическую значимость и могут быть применены для стратификации больных в зависимости от риска рецидивирования и прогрессирования опухоли.



