Несмотря на все достижения современной анестезиологии, все еще остаются нерешенными многие проблемы: одна из них – прогнозирование течения анестезии и предупреждение возникновения критических инцидентов и осложнений во время анестезии и в послеоперационном периоде. В настоящее время существует множество шкал и систем прогнозирования, но все еще невозможно предсказать риск в каждой конкретной клинической ситуации. Необходимо произвести поиск метода обследования, который сможет дать точную оценку состояния пациента и его индивидуальной стрессорной устойчивости, то есть насколько адекватно смогут отреагировать адаптационные механизмы компенсации конкретного человека на операционный стресс.
Метод оценки чувствительности периферического хеморефлекса с помощью проведения пробы с пороговой задержкой дыхания является одним из перспективных способов прогнозирования. Этот метод является простым и безопасным, он дает возможность получения объективных сопоставимых данных и способен оценить индивидуальный уровень стрессорной устойчивости [1, 2].
Цель исследования – с помощью метода измерения индивидуальной чувствительности периферического хеморефлекса оценить возможность прогнозирования течения эпидуральной анестезии, рассчитать риск возникновения интраоперационных критических инцидентов и послеоперационных осложнений.
Материалы и методы исследования
Проспективное наблюдательное слепое исследование. Количество пациенток в исследовании – 62, их средний возраст был в пределах 40,4±7,1 лет. Всем пациенткам выполнялись плановые гинекологические операции лапаротомическим доступом в условиях эпидуральной анестезии (ЭА) с седацией (надвлагалищная ампутация матки с придатками или без, экстирпация матки). Длительность операций – 51,2±18,1 мин. По классификации ASA физический статус пациенток – 1–2 класс. Данное исследование было одобрено решением независимого локального этического комитета Кубанского государственного медицинского университета (протокол № 48 от 20.02.2017).
Из исследования исключались пациентки с массивным интраоперационным кровотечением и в состоянии гиповолемии. В исследование не включались пациентки с ожирением (ИМТ более 30 кг/м2), а также имеющие неврологические и психические заболевания.
Оценка чувствительности периферического хеморефлекса (ЧПХ) измерялась по продолжительности произвольного порогового апноэ (ППА) при проведении пробы с задержкой дыхания. Измерение производилось трехкратно за день до операции перед применением премедикации. Продолжительность ППА измерялась от начала пробы с задержкой дыхания до рефлекторных сокращений диафрагмы, которые определяли с помощью пальпации [1].
Для премедикации назначался феназепам (1 мг на ночь и утром). Индукция ЭА проводилась 1 % ропивакаином (120–150 мг) в предварительно катетеризированное эпидуральное пространство. Поддержание анестезии – 0,2 % ропивакаином со скоростью 8–10 мл/ч. Уровень и адекватность блока оценивались через 10–20 мин после индукции ЭА. Для седации применяли 1 % раствор пропофола 0,3–1,4 мг·кг-1·ч-1. Во время анестезии по шкале ASA (American Society of Anesthesiologists) оценивали глубину седации.
В исследовании документировались критические инциденты (КИ) и послеоперационные осложнения: гемодинамические (гипотензия, гипертензия, брадикардия, аритмия и тахикардия), респираторные (гипоксемия, гиперкапния, потребность в ИВЛ), метаболические (гипотермия), интраоперационная и послеоперационная тошнота и рвота. Интенсивность боли в ближайшем послеоперационном периоде оценивалась по визуально-аналоговой шкале (ВАШ).
При проведении ЭА проводился стандартный мониторинг, артериальное давление (АД) измеряли осциллометрическим неинвазивным методом с помощью монитора. Ударный индекс (УИ) и сердечный индекс (СИ) оценивался неинвазивным методом расчета времени передачи пульсовой волны (esCCO) монитором Nihon Kohden (Nihon Kohden Corporation, Япония) [3], а общее периферическое сосудистое сопротивление (ОПСС) рассчитывалось расчетным методом.
Если во время анестезии происходило снижение среднего АД в течение 30 мин после индукции ЭА до 60 мм рт. ст. у пациенток без гипертонической болезни или до 70 мм рт. ст. у пациентов с артериальной гипертензией и/или понижение среднего АД более чем на 30 % от исходного значения за 10 мин [4], то это считалось гипотензией. В случае гипотензии для стабилизации артериального давления использовали вазопрессоры – внутривенное болюсное введение фенилэфрина в дозе 50–150 мкг в зависимости от уровня снижения среднего АД.
Повышение систолического АД на 20 % выше обычного значения или более 160 мм рт. ст. расценивали как гипертензию [5]. Снижение частоты сердечных сокращений (ЧСС) менее 50 ударов в минуту оценивалось как брадикардия [6]. Повышение ЧСС более чем на 20 % от обычных значений или более 100 ударов в минуту считали тахикардией [7].
Инфузионная терапия во время анестезии осуществлялась растворами кристаллоидов (0,9 % раствор NaCl) 10–15 мл•кг-1•ч-1. Если снижение среднего артериального давления было быстрым и выраженным (более 40 % за 5 мин), производилось изменение инфузионной терапии – к раствору кристаллоидов добавлялся раствор желатина (гелофузин) 500 мл.
Снижение SpO2 (процентного содержания оксигемоглобина в артериальной крови) менее 95 % считалось гипоксемией, а увеличение РetCO2 (парциального давления углекислого газа в выдыхаемой газовой смеси) более 40 мм рт. ст. – гиперкапнией [8]. Понижение температуры тела ниже 36 °С расценивали как гипотермию [9].
В послеоперационном периоде обезболивание осуществлялось по протоколу мультимодальной анальгезии [10]: ропивакаин 0,2 % в эпидуральное пространство со скоростью 3–6 мл/ч, неопиоидные анальгетики (кетопрофен 5 % 200–400 мг внутримышечно), опиоидные анальгетики (тримеперидин 2 % 20–60 мг внутримышечно, если у пациенток возникала потребность в применении наркотических анальгетиков).
С помощью программ Statistica 12.0 (StatSoft Inc., США) и IBM SPSS Statistics 26 (IBM Corp., США) осуществлялись статистические расчеты. С помощью теста Шапиро – Уилка и теста Колмогорова – Смирнова проводилась проверка гипотезы о правильном распределении данных. При выявлении нормального распределения данные считались параметрическими, и они были приведены в виде среднего значения и стандартного отклонения. При выявлении ненормального распределения данные считались непараметрическими, и они были приведены в виде медианы и межквартильного диапазона (25–75 перцентили).
Хи-квадрат (Chi-square) (критерий Пирсона) использовался для сравнения категориальных данных. Непараметрические данные анализировались с использованием U-критерия Манна – Уитни и Т-критерия Уилкоксона. Параметрические данные – с помощью непарного и парного t-критерия Стьюдента. Уровень р менее 0,05 считался статистически значимым.
Для оценки возможности прогнозирования течения эпидуральной анестезии у гинекологических пациенток с помощью определения индивидуальной чувствительности периферического хеморефлекса применялся метод построения ROC-кривых (Receiver Operator Characteristic). Расчет площади под ROC-кривой (AUC) применяли для оценки прогностической значимости модели прогнозирования.
Результаты исследования и их обсуждение
У всех пациенток эпидуральная анестезия была адекватной. По шкале ASA глубину седации в течение анестезии поддерживали на уровне умеренной седации/аналгезии. При оценке уровня и адекватности блока верхняя граница кожной анальгезии доходила до уровня Т5-7.
При проведении исследования единственным зарегистрированным интраоперационным критическим инцидентом была гипотензия. Частота гипотензии при ЭА была 17,7 % (11 пациенток). Из послеоперационных критических инцидентов и осложнений была выявлена послеоперационная тошнота и рвота (ПОТР), ее частота составила 11,3 % (7пациенток).
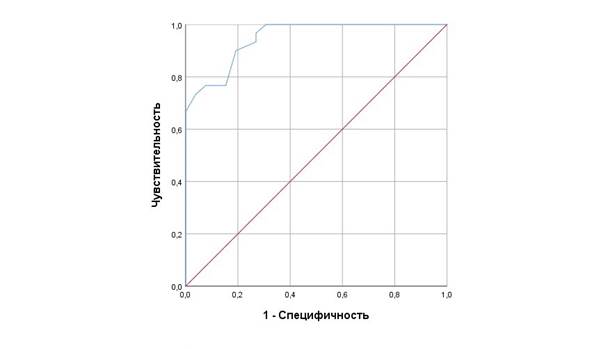 |
Для оценки возможности прогнозирования течения эпидуральной анестезии у гинекологических пациенток с помощью определения индивидуальной чувствительности периферического хеморефлекса была построена ROC-кривая (рисунок).
ROC кривая – характеристика прогностической модели длительности ППА в отношении развития критических инцидентов и осложнений при ЭА
Значение площади под кривой (AUROC = 0,955) свидетельствует о высокой достоверности данного метода прогнозирования при ЭА. По данным ROC анализа (Sensitivity – 93,1, Specificity – 81,5, точка отсечения – 32) у пациенток с величиной ППА равной или менее 32 с была высокая вероятность развития КИ и осложнений. Данный метод прогнозирования показал высокую чувствительность (93,1 %) и специфичность (81,5 %).
Исходя из полученных данных, в исследовании была выделена группа пациенток высокого риска развития КИ и осложнений, поэтому все пациентки для проведения дополнительного статистического анализа (подтверждение метода прогнозирования) по продолжительности пробы с задержкой дыхания были распределены на две группы: пациентки со значением ППА менее или равным 32 с были отнесены в группу высокого риска (группа «1»), а пациентки со значением ППА более 32 с в группу низкого риска (группа «2») (табл. 1).
Таблица 1
Характеристика групп исследования
|
Признак |
Группа «1» |
Группа «2» |
р |
|
Количество больных |
30 |
32 |
– |
|
Средний возраст, лет |
43,2 ± 9,3 |
42,7 ± 9,2 |
p > 0,05* |
|
Средняя продолжительность операций, мин |
51,4 ± 18,3 |
52,3 ± 18,8 |
p > 0,05* |
|
Физический статус пациенток по классификации ASA, класс |
1–2 |
1–2 |
p > 0,05* |
|
Рост, см |
165,7 ± 4,5 |
165,6 ± 7,8 |
p > 0,05* |
|
Вес, кг |
68,9 ± 9,9 |
68,7 ± 10,1 |
p > 0,05* |
|
Средний ИМТ (индекс массы тела), кг/м2 |
25,8 ± 3,6 |
24,9 ± 2,9 |
p > 0,05* |
|
* U-критерий Манна – Уитни |
|||
С 14-й минуты индукции ЭА у пациенток наблюдалось снижение артериального давления (p < 0,05 для обеих подгрупп в сравнении с исходным значением, Т-критерий Уилкоксона), ЧСС, ОПСС (p < 0,05 для обеих подгрупп в сравнении с исходным значением, Т-критерий Уилкоксона) и компенсаторное повышение СИ и УИ, которое к 40-й минуте анестезии достигало максимума (табл. 2).
Таблица 2
Течение ЭА у пациенток группы «1» и «2»
|
|
Группа «1» |
Группа «2» |
р |
|
Снижение АДср к 14 минуте анестезии, % |
23,3 ± 9,6 |
12,2 ± 9,4 |
р < 0,05* |
|
Снижение АДср к 40 минуте анестезии, % |
29,9 ± 12,7 |
20,6 ± 9,2 |
р < 0,05* |
|
Частота встречаемости гипотензии, % |
33,3 |
3,1 |
р < 0,05** |
|
Снижение ЧСС к 40 минуте анестезии, % |
12,3 ± 11,2 |
10,4 ± 9,1 |
p > 0,05* |
|
Снижение ОПСС к 40 минуте анестезии, % |
39,8 ± 14,8 |
37,9 ± 14,1 |
p > 0,05* |
|
Повышение УИ к 40 минуте анестезии, % |
13,3 ± 3,6 |
62,2 ± 4,3 |
р < 0,05* |
|
Повышение СИ к 40 минуте анестезии, % |
2,6 ± 0,8 |
31,3 ± 1,4 |
р < 0,05* |
|
Частота использования вазопрессоров, % |
33,3 |
3,1 |
р < 0,05** |
|
SpO2, % |
99,1 ± 0,9 |
99,1 ± 0,9 |
p > 0,05* |
|
РetCO2, мм рт. ст. |
30,1 ± 1,6 |
29,9 ± 1,7 |
p > 0,05* |
|
Скорость инфузионной терапии, мл·кг-1·ч-1 |
27,4 ± 9,3 |
23,6 ± 11,5 |
р < 0,05* |
|
Скорость диуреза, мл·кг-1·ч-1 |
2,57 ± 1,43 |
2,75 ± 1,13 |
p > 0,05* |
|
Объем интраоперационной кровопотери, мл |
55,0 ± 16,7 |
55,0 ±15,8 |
p > 0,05* |
|
Центральная температура тела, °С |
36,5 ± 0,1 |
36,5 ± 0,1 |
p > 0,05* |
|
Периферическая температура тела, °С |
36,4 ± 0,2 |
36,4 ± 0,2 |
p > 0,05* |
|
Частота ПОТР, % |
20 |
3,1 |
р < 0,05* |
|
* U-критерий Манна – Уитни ** Хи-квадрат (Chi-square) (критерий Пирсона) |
|||
Причиной гипотензии при ЭА в группе «1» стало более выраженное снижение АДср (р < 0,05), ОПСС и ЧСС и менее выраженное компенсаторное повышение УИ (р < 0,05) и СИ (р < 0,05).
Коррекция гемодинамики потребовала у пациенток группы «1» более частого применения вазопрессоров, суммарная доза фенилэфрина в группе «1» была выше, чем в группе «2». Частота применения вазопрессоров была 33,3 % в группе «1» и 3,1 % в группе «2» (р < 0,05). Вследствие более часто возникающей и более выраженной гипотензии состав компонентов инфузионной терапии в группе «1» потребовал изменения (возникла необходимость в добавлении раствора гелофузина), также наблюдалось вынужденное увеличение объема и скорости инфузионной терапии в группе «1» (р < 0,05).
Между группами исследования не было отмечено статистически значимых различий скорости диуреза. Интервал ST во II отведении, регистрируемый по данным электрокардиографии по монитору во время анестезии, колебался в диапазоне от – 0,4 до + 0,4 мм в обеих группах, ишемии во время анестезии не возникало.
В группе «1» более часто наблюдалась ПОТР, она была зарегистрирована у 20 % пациенток (p < 0,05). По длительности и количеству эпизодов рвоты тяжесть течения ПОТР была также более выраженной у пациенток группы высокого риска развития КИ и осложнений.
В ближайший послеоперационный период интенсивность боли, определяемая по визуально-аналоговой шкале, была 2‒6 баллов у пациенток обеих групп, в группе «1» частота использования наркотических анальгетиков составила 10 %, в группе «2» – 6,2 %, статистически значимых различий выявлено не было.
Таким образом, полученные автором результаты исследования подтверждают высокую достоверность метода прогнозирования течения эпидуральной анестезии с помощью определения индивидуальной чувствительности периферического хеморефлекса. Данный метод прогнозирования имеет высокую чувствительность и специфичность.
Существует значительная разница в описании понятия гипотензии в различных исследованиях, обусловленная их дизайном и методами, используемыми для сбора данных. Например, даже интервалы между измерениями АД и способ измерения (инвазивный или нет) могут влиять на регистрируемую частоту гипотензии. Также присутствует связь гипотензии с возрастом пациентов и наличием сопутствующих заболеваний (артериальной гипертензии, сахарного диабета, ожирения и т.д.). Частота гипотензии может зависеть от вида и объема оперативного вмешательства, а также от кровопотери до и во время операции. В различных исследованиях описана частота гипотензии при ЭА в диапазоне от 13 до 54 % [11–13].
Вследствие того, что при ЭА возникает артериальная вазодилатация, это и становится причиной гипотензии, поэтому рекомендуется осуществлять коррекцию АД с помощью вазопрессоров (таких как фенилэфрин). Обычно при этом не наблюдается дефицит преинфузии или депрессия миокарда, поэтому избыточная инфузионная терапия или инотропная поддержка могут быть неуместными или даже опасными для пациентов [13].
Чувствительность артериального барорефлекса может снижаться у пациентов с высокой чувствительностью периферического хеморефлекса (низкие значения ППА), это происходит вследствие возникающих изменений в рефлекторной регуляции кардиореспираторной системы. При этом наблюдается снижение функциональных резервов сердечно-сосудистой системы, и при возникновении экстренной стрессорной ситуации компенсаторные реакции у данных пациентов не в состоянии сгладить негативное влияние анестезии на гемодинамический профиль [14].
Полученные автором результаты исследования подтверждают этот факт: у пациентов с высокой чувствительностью периферического хеморефлекса вазодилатация, связанная с симпатической блокадой при ЭА, плохо компенсируется повышением УИ и СИ.
У гинекологических пациенток исходно имеется высокая вероятность развития ПОТР, связанная с влиянием гормональных факторов. Частота ПОТР у данных категорий пациенток может достигать 75 %. Если для послеоперационного обезболивания применяются наркотические анальгетики, то это тоже может существенно повысить риск возникновения ПОТР, но и отказ от опиоидов в ближайшем послеоперационном периоде увеличивает риск ПОТР из-за висцеральной боли. На частоту ПОТР способны оказывать влияние молодой возраст пациенток, хирургические особенности гинекологических операций и наличие эмоциональной лабильности [15, с. 24–29; 16]. Возникновение гипотензии во время анестезии также может спровоцировать дальнейшее развитие тошноты и рвоты [15].
Выводы
1. Способ прогнозирования течения ЭА с помощью определения индивидуальной чувствительности периферического хеморефлекса имеет высокую достоверность, чувствительность и специфичность.
2. У пациенток с величиной ППА равной или менее 32 с при проведении ЭА имеется высокая вероятность развития интраоперационных критических инцидентов и послеоперационных осложнений.
3. Частота встречаемости гипотензии при ЭА у гинекологических пациенток составила 17,7 %: в группе пациенток высокого риска развития КИ и осложнений – 33,3 %, в группе низкого риска – 3,1 %.
4. Частота послеоперационной тошноты и рвоты при ЭА была 11,3 %: в группе пациенток высокого риска – 20 %, в группе низкого риска – 3,1 %.
5. Высокая чувствительность периферического хеморефлекса (величина ППА равна или менее 32 с) у гинекологических пациенток при проведении ЭА позволяет прогнозировать нестабильность гемодинамики во время анестезии. Артериальная вазодилатация, возникающая при ЭА, у пациенток с высокой чувствительностью периферического хеморефлекса недостаточно компенсируется повышением ударного и сердечного индекса.
6. Нестабильность гемодинамики при проведении ЭА является предиктором возникновения послеоперационной тошноты и рвоты.



