Среди эндокринной патологии, с которой приходится сталкиваться клиницисту, синдром эктопической продукции адренокортикотропного гормона (АКТГ-эктопический синдром, АКТГ-ЭС) – паранеопластический синдром вследствие избыточной продукции нейроэндокринной опухолью (НЭО) адренокортикотропного гормона (АКТГ), АКТГ-подобных веществ или, возможно, кортикотропин-рилизинг-гормона (КРГ), встречается достаточно редко, при этом его клинические проявления могут быть крайне тяжелыми [1-3]. По данным некоторых авторов, распространенность АКТГ-ЭС среди всех случаев АКТГ-зависимого гиперкортицизма составляет 5–20% [2; 4; 5].
Известно, что НЭО представлены недифференцированными клетками пептидэргической нейроэндокринной (АПУД) системы, представленной фактически по всему организму. Способность продуцировать АКТГ выявлена у опухолей различных локализаций и степени злокачественности, а термин «карциноид» относится только к НЭО легких и бронхов [3; 6].
В 25-46% случаев источником гиперсекреции АКТГ может быть карциноид легких. НЭО иных локализаций встречаются не так часто: вилочковой железы в 5–16%, НЭО поджелудочной железы и мелкоклеточный рак легких в 18–20%, а опухоли иных локализаций (желудочно-кишечного тракта, медуллярный рак щитовидной железы, феохромоцитома, мезотелиома, опухоли околоушных желез, рак пищевода, желудка, кишечника, молочной железы, яичников, матки, предстательной железы) встречаются еще более редко [4; 5; 7].
Типичный карциноид (ТК) верифицируют примерно в 2% случаев злокачественных новообразований легкого [2; 8; 9]. Он характеризуется низкой степенью злокачественности, медленным ростом и низкой пролиферативной активностью. Несмотря на высокую пятилетнюю выживаемость после радикального оперативного лечения (около 88%), могут выявляться метастазы в региональные лимфатические узлы (10–15% случаев) или отдаленные метастазы в печень и кости скелета (в 3-5% случаев) [3-5].
Длительное время опухоль может не давать явной клинической симптоматики. В таких случаях диагностировать НЭО становится возможным лишь когда опухоль достигает большого размера и появляется клиника быстропрогрессирующего эндогенного гиперкортицизма. По данным литературы, длительность заболевания до выявления очага гиперпродукции АКТГ составляет от 1 месяца до 5 лет [7-9].
Согласно данным литературы, типичными для клиники АКТГ-ЭС являются артериальная гипертензия (в 92%), астения, общая слабость, стероидный сахарный диабет, отеки конечностей (в 75%), мышечная слабость (в 67%), ломкость капилляров (в 58%), типичный кушингоидный фенотип (в 58%), прирост массы тела (в 58%). При этом другие характерные для избытка кортизола симптомы (гиперпигментация, вирильный синдром, нарушение менструального цикла, изменения психического статуса, стероидный остеопороз, частые инфекции) встречаются существенно реже [8; 10; 11]. Стоит обратить внимание на характерные лабораторные изменения: гипокалиемия (в том числе значительно выраженная, сопровождающаяся развитием метаболического алкалоза) встречается у 92% пациентов, выраженный лейкоцитоз – у 67% [6; 8; 12]. Типичным состоянием, ассоциированным с гиперкортицизмом, также можно считать и стероидную коагулопатию с рецидивирующими венозными тромбозами [3; 13].
Общеизвестно, что алгоритм диагностики гиперкортицизма предусматривает подтверждение факта стойкого гиперкортизолизма (подавляющий тест с 1 мг дексаметазона и суточная экскреция кортизола с мочой), далее – оценку уровня АКТГ для исключения надпочечниковой формы заболевания. В последующем необходимо проведение дифференциальной диагностики гипофизарного и эктопического варианта АКТГ-зависимого синдрома (подавляющий тест с 8 мг дексаметазона, забор крови из нижних каменистых синусов). Известно, что в ряде случаев при АКТГ-ЭС проба с 8 мг дексаметазона может быть положительной (в 50% случаев рака легкого и в 85% случаев бронхиальных карциноидов), что было связано с продукцией эктопированной опухолью КРГ [6; 12]. Принято считать, что «золотым стандартом» диагностики АКТГ-ЭС является селективный забор крови из нижних каменистых синусов [12-14]. Отмечено, что типичным лабораторным проявлением АКТГ-ЭС является существенное повышение уровня суточной экскреции кортизола (до 6 норм) [1]. Обращает на себя внимание характерная ассоциация АГ и гипокалиемии, что связывают с минералокортикоидной активностью избытка ГКС [6; 14; 15].
Поиск источника эктопической продукции АКТГ является основной проблемой при данной патологии. Зачастую рутинное использование мультиспиральной компьютерной томографии (МСКТ) или магнитно-резонансной томографии (МРТ) грудной полости, брюшной полости, забрюшинного пространства не позволяют визуализировать опухоль, необходимо проведение позитронно-эмиссионной томографии с 68Ga-DOTATE, 68Ga-DOTA-NOC, 18F-дезоксиглюкозой (причем требуются повторные исследования с различными радионуклидами), а также сцинтиграфии с меченым октреотидом [12; 14; 15].
Для контроля симптомов гиперкортицизма до выполнения радикального удаления очага АКТГ-эктопии используют аналоги соматостатина пролонгированного действия, ингибиторы стероидогенеза, а в некоторых случаях используется комбинированная терапия [15-17]. При бурной, осложненной клинике гиперкортицизма и невозможности своевременного обнаружения первичного опухолевого очага для достижения терапевтического эффекта возникает необходимость проведения двусторонней адреналэктомии (выполняется у 30% больных) [10; 15; 18]. Топическая диагностика источника гиперпродукции АКТГ может существенно затянуться, приводя к несвоевременному оперативному лечению и, как следствие, развитию жизнеугрожающих осложнений гиперкортицизма.
В условиях хирургического стационара авторы наблюдали несколько случаев тяжелого течения АКТГ-ЭС у пациентов с типичным карциноидом легкого.
Клинический случай 1. Пациентка Л., 48 лет, поступила в клинику госпитальной хирургии Военно-медицинской академии 25.01.2022 г. для проведения оперативного лечения по поводу злокачественного новообразования легкого.
Из анамнеза: в мае 2016 г. пациентка впервые отметила одутловатость и покраснение лица, за медицинской помощью не обращалась. Осенью 2017 г. в связи с появлением выраженной общей и мышечной слабости, аменореи, перераспределением подкожной жировой клетчатки (преимущественно на лице и туловище) был заподозрен эндогенный гиперкортицизм. Осмотрена эндокринологом, подтверждено повышение базального кортизола до 991,2 нмоль/л (171-536), снижение фолликулостимулирующего (ФСГ) гормона до 1,37 мМЕ/мл (1,7-21,5) при нормальных уровнях тиреотропного (ТТГ) гормона, эстрадиола и пролактина. Подавляющих проб с дексаметазоном не проводилось, при КТ надпочечников (17.10.2017 г.) данных за объемный процесс не выявлено.
Весной 2018 г. стало появляться повышение АД до 150/90 мм рт. ст. Зафиксировано повышение уровня АКТГ до 14,56 нмоль/л (1,03-10,7) и отсутствие подавления кортизола в пробе с 1 мг дексаметазона (590,9 нмоль/л (<50)). Диагностировано нарушение углеводного обмена (глюкоза через 2 часа после приема 75 г глюкозы 11,8 ммоль/л (<7,8)).
При стационарном обследовании в мае 2018 г. в Центре патологии надпочечников СЗГМУ им. И.И. Мечникова подтверждено нарушение циркадности кортизола (в 9:00 ч 510 нмоль/л (138-690), 21:00 ч 519 нмоль/л (70-345)) и повышение базального АКТГ до 154 пг/мл (<46). Не было подавления кортизола в функциональных пробах с дексаметазоном: с 1 мг (317 нмоль/л (<50)) и с 8 мг (301 нмоль/л). На МРТ гипофиза (10.06.2018 г.) в центральных отделах аденогипофиза визуализировался участок неправильной формы с четкими контурами размерами 4х4х3 мм. Для исключения гипофиззависимой формы гиперкортицизма проведен селективный забор крови из нижних каменистых синусов: если в периферической вене АКТГ был повышен до 73 пг/мл, то одновременно в нижнем каменистом синусе слева показатель составлял 481 пг/мл, а справа - 106 пг/мл. Очаговые изменения в гипофизе и значительное превышение порогового значения градиента концентрации АКТГ синус/периферическая вена (до 6,5) безусловно подтверждали наличие у пациентки кортикотропиномы.
После осмотра нейрохирургом и радиологом принято решение о проведении стереотаксического радиохирургического вмешательства на гипофизе. Однако в послеоперационном периоде клинического и лабораторного улучшения не было достигнуто: на фоне прогрессирующей клиники гиперкортицизма сохранялось повышение уровня АКТГ (72,9 пг/мл (<46)), существенное повышение базального кортизола (1216,1 нмоль/л (138-690)), нарастание гипокалиемии (2,99 ммоль/л (3,5-5,0)). При этом отсутствовала существенная динамика размеров аденомы гипофиза по данным повторного МРТ (в аденогипофизе участок до 3 мм, не накапливающий контрастное вещество).
Пациентка повторно консультирована нейрохирургом, было принято решение о хирургическом лечении кортикотропиномы. В связи с прогрессированием коагулопатии (эпизод тромбоза глубоких вен правой нижней конечности в марте 2019 г.) операция отложена до окончания курса лечения антикоагулянтами.
В августе 2019 г. проведена эндоназальная эндоскопическая аденомэктомия. Обращало на себя внимание, что результаты гистологического исследования показали наличие некротизированной ткани и коллоида. При повторном селективном заборе крови из нижних каменистых синусов уровень АКТГ в периферической крови и в нижних каменистых синусах оказался практически одинаковым (АКТГ в периферической вене 64,8 пг/мл, АКТГ в каменистых синусах справа 81,9 пг/мл, слева - 78,3 пг/мл). Полученные результаты обследования отчетливо свидетельствовали о том, что у пациентки появился внегипофизарный источник гиперпродукции АКТГ.
Состояние пациентки продолжало ухудшаться: усилилась мышечная слабость, боли в позвоночнике, увеличился вес (на 8 кг за 3 месяца). Диагностирован стероидный диабет (глюкоза (плазма венозной крови) 14,2 ммоль/л (<5,6)), стероидный остеопороз (компрессионные переломы грудных (Th9, Th12, Th8) позвонков 3 степени). При гастроскопии подтверждено наличие хронической язвы антрального отдела желудка. Сохранялось повышение базального кортизола (507,8 нмоль/л (138-690)), АКТГ (95 пг/мл (<46)), повышение суточной экскреции кортизола с мочой (1422 мкг/сут. (58-403)). При проведении высокоэффективной жидкостной хроматографии (ВЭЖК) мочи было выявлено повышение свободного кортизола до 26,7 мкг/с и 18-гидроксикортикостерона до 93,5 мкг/с.
Бурное прогрессирование симптомов гиперкортицизма со множественными осложнениями заставило задуматься о необходимости «терапии отчаяния» - двусторонней адреналэктомии. В декабре 2019 г. выполнена операция, назначена заместительная терапия гидрокортизоном (в суточной дозе до 40 мг). На фоне приема препарата сохранялись общая и мышечная слабость, отеки голеней и стоп. Обращала на себя внимание стойкая гипокалиемия (2,8 ммоль/л). Коррекция терапии (замена на преднизолон в суточной дозировке до 7,5 мг) позволила несколько улучшить общее состояние: уменьшилась слабость, отеки, нормализовались углеводный обмен, уровень АД и электролитов, снизился вес на 5 кг. Одновременно с этим отмечено нарастание гиперпродукции АКТГ (372 пг/мл (<46)), источник которой так и не был визуализирован. Для лабораторного подтверждения наличия нейроэндокринной опухоли 20.01.2020 г. проведен анализ крови на хромогранин А (43,7 нг/мл (0-108)), а рекомендация проведения ПЭТ-КТ с целью поиска опухоли реализована не была.
Ухудшение клинической картины произошло с мая 2020 г., когда вновь повысился уровень АД, пациентка прибавила в весе (5 кг за 6 месяцев), появились отечность и гиперемия лица, появление кровоподтеков при незначительной травматизации кожи, нестабильность гликемии. При очередной госпитализации в ноябре 2020 г. зафиксировано значительное повышение уровня хромогранина А до 180 нг/мл (0-108) и впервые на рентгенограмме ОГК выявлены очаговые тени до 1,5 см с четкими контурами преимущественно справа.
С целью уточнения локализации опухоли выполнена ПЭТ-КТ с галлием (02.12.2020 г.): данных за неопластический процесс в легких не получено; в ложе обоих надпочечников определялись образования: справа размерами 31х14х12 мм (+29 HU, с контрастным усилением до +140 HU), слева 17х11х21 мм (+16 HU, с контрастным усилением до +142 HU). В это же время у пациентки нарастали проявления коагулопатии. Данные КТ органов грудной полости свидетельствовали о наличии тромбоэмболии среднедолевой и нижнедолевой ветвей легочной артерии, инфаркт-пневмонии в средней доле справа с абсцедированием. Обращало на себя внимание (рис. 1) наличие узлового, мягкотканного (+26+45HU) образования S2 левого легкого размером 10×9 мм с обструкцией субсегментарного бронха (НЭО?).

Рис. 1. Очаговое образование S2 левого легкого на КТ органов грудной полости пациентки Л.
Полученные данные позволили верифицировать АКТГ-зависимую форму эндогенного гиперкортицизма тяжелой степени (рецидив), наличие объемных образований обоих надпочечников (гиперплазированная остаточная ткань). Консультирована торакальным хирургом, подтверждено наличие инфаркт-пневмонии средней доли правого легкого неуточненной давности, выполнена бронхоскопия, выявлен двусторонний диффузный катаральный эндобронхит 1-2 ст., щипковая биопсия не была проведена ввиду тяжелого коморбидного фона и технических сложностей доступа. Проводилась антибактериальная (левофлоксацин 400 мг/сут.) и патогенетическая терапия инфаркт-пневмонии.
С февраля 2021 г. клинические проявления ухудшились: прогрессировала общая и мышечная слабость (отсутствие возможности встать с кровати без помощи рук, сложности при выполнении обычной физической активности), появились эпизоды обморочных состояний, отсутствовал аппетит, появилась тошнота, головокружение, апатия, снизился вес (5 кг за 2 месяца). Появлению симптомов предшествовала самостоятельная отмена пациенткой заместительной терапии преднизолоном. В апреле 2021 г. подтверждена декомпенсация послеоперационной надпочечниковой недостаточности (АКТГ в 9:00 ч 44 пг/мл (<46), в 21:00 ч 122 пг/мл; кортизол в 9:00 ч <27,6 нмоль/л (138-690), в 21:00 ч 177 нмоль/л (70-345); кортизол суточной мочи 15,9 мкг/сут. (20-65); альдостерон (горизонтальное положение) 30,8 пг/мл (13-145), калий 3,6 ммоль/л (3,5-5,0)). Стационарно проведена коррекция заместительной терапии, рекомендован постоянный прием кортизона ацетата 12,5 мг/сут. В дальнейшем (при стационарном обследовании в ноябре 2021 г.), после нормализации общего состояния и улучшения лабораторных изменений (АКТГ в 9:00 ч 70,4 пг/мл (<46), в 21:00 ч 159 пг/мл (<20); кортизол в 9:00 ч 135 нмоль/л (138-690), в 21:00 ч 288 нмоль/л (70-345); калий 3,7 ммоль/л (3,5-5,0)), пациентке рекомендован прием препарата в режиме «по требованию» с коррекцией терапии при стрессовых нагрузках.
Учитывая сомнительные характеристики объемного образования верхней доли левого легкого (накопление радиофармпрепарата (РФП) по данным ПЭТ-КТ с 65 Ga DOTA TETE/Noc), гиперпродукцию АКТГ и повышение уровня хромогранина А, повторно осмотрена торакальным хирургом, рекомендовано удаление НЭО левого лёгкого в плановом порядке.
В январе 2022 г. пациентка госпитализирована в клинику госпитальной хирургии Военно-медицинской академии в плановом порядке. При объективном осмотре обращало на себя внимание незначительно выраженное перераспределение подкожно-жировой клетчатки (на лице и туловище) при нормальном ИМТ 24,1 кг/м2. Уровень кортизола, АКТГ, электролитов не оценивался. По данным спирометрии: обструктивных и рестриктивных нарушений не выявлено.
Выполнена торакоскопическая левосторонняя лобэктомия. По результатам гистологического исследования: морфологическая картина НЭО легкого рТ1вN2 (иммунофенотип опухоли соответствовал типичному карциноиду). При цитологическом исследовании: Ki 67-1%, TTF1 отрицательный, CK7 отрицателен, хромогранин A выраженное диффузное окрашивание клеток опухоли, Syn выраженное диффузное окрашивание клеток опухоли, PAX8 отрицательная экспрессия, CK20 отрицателен.
Учитывая анамнез (двусторонняя адреналэктомия), в периоперационный период проводилась заместительная терапия ГКС в супрафизиологических дозировках (преднизолон по схеме со 100 мг/сутки с постепенным уменьшением дозировки до поддерживающей). Проводился мониторинг гемодинамических показателей, гликемии и электролитов с последующей титрацией дозировки ГКС и минералкортикоидов. После проведения оперативного лечения отмечена положительная динамика в виде нормализации общего самочувствия, улучшения переносимости физических нагрузок, нормализации лабораторных показателей. Примечательно, что уровень АКТГ после операции составлял 1,0 пг/мл (7,2-63).
За последующий период наблюдения (в течение 2 лет): общее состояние удовлетворительное. Общей и мышечной слабости нет, углеводный обмен нормализовался. АД 90-110/70 мм рт. ст., ЧСС 60-80 в мин., масса тела в пределах 58-60 кг. При анализе лабораторных показателей от февраля 2023 г.: АКТГ в 9:00 4,42 (7,7-63,3) пг/мл, кортизол в 9:00 526,8 (150-660) нмоль/л, альдостерон (горизонтальное положение) 19,6 пг/мл (13-145), калий крови 3,9 ммоль/л, суточная экскреция кортизола в моче 34,4 мкг/сут. (20-65). При КТ органов грудной полости очаговых образований не выявлено. ПЭТ КТ с 68Ga-DOTATE не показало очагов накопления РФП. Пациентка продолжает заместительную терапию преднизолоном в режиме «по требованию» 2,5 мг 1 раз в несколько дней под контролем общего состояния.
Клинический случай 2. Пациент С., 32 лет, поступил в клинику госпитальной хирургии Военно-медицинской академии 23.11.2022 г. для проведения оперативного лечения по поводу очагового образования легкого.
Из анамнеза известно, что в начале июня 2022 г. обратился к урологу по поводу болей в поясничной области. Патологии не выявлено, обращала на себя внимание транзиторная глюкозурия. Уже в конце июня 2022 г. обратил внимание на появление эпизодов нестерпимого чувства голода. При обследовании у эндокринолога данных за нарушение углеводного обмена и нарушений функции щитовидной железы не выявлено (HbA1c менее 6%, глюкоза (плазма венозной крови) натощак 5,0 ммоль/л); ТТГ 0,39 мкМЕ/мл (0,3-4,0), антитела к рецептору ТТГ (АТ-рТТГ) <0,8 МЕ/л (<1,0)).
С середины августа 2022 г. появились быстро нарастающие симптомы: отёчность голеней, стоп, одышка при обычной нагрузке, общая и мышечная слабость, потливость, приливы жара, округление лица, потеря мышечной массы (преимущественно за счет мышц конечностей). В начале сентября 2022 г. при повторном обращении к эндокринологу обнаружены нарушения углеводного обмена (глюкоза (плазма венозной крови) натощак 5,64 ммоль/л, через 2 ч после приема 75 г глюкозы 11,03 ммоль/л (<7,8)), глюкозурия. Обращало на себя внимание появление субклинического тиреотоксикоза (ТТГ 0,08 мкМЕ/мл (0.3-4,0), свободный Т4 17,86 пмоль/л (10,8-22), АТ-рТТГ 1,7 МЕ/л (<1,0), антитела к тиреопероксидазе (АТ-ТПО) 6,45 МЕ/мл (<34)). Данных за аутоиммунный полигландулярный синдром не получено (уровень антител к декарбоксилазе глютаминовой кислоты (GAD) 0,09 МЕ/мл (0-5)). Пероральную сахароснижающую терапию и тиреостатики не использовал. На фоне ухудшения состояния 15.09.2022 г. в экстренном порядке был госпитализирован в городской эндокринологический стационар. По результатам обследования диагностированы впервые выявленный сахарный диабет (MODY?) и подострый тиреоидит, субклинический тиреотоксикоз. Рекомендован прием метформина.
Общее состояние пациента продолжало прогрессивно ухудшаться. При повторном амбулаторном обследовании эндокринологом выявлен эндогенный гиперкортицизм (кортизол крови 09:00 ч 1445,0 нмоль/л (138-690), кортизол слюны 23:00 ч 208,3 нмоль/л (<7,56)), гипогонадизм (общий тестостерон 4,5 нмоль/л (>12,0)). На МРТ гипофиза патологических изменений выявлено не было.
Резкое ухудшение состояния 23.09.2022 г., сопровождавшееся брадикардией (40 уд./мин.) вновь потребовало экстренной госпитализации, исключен синдром слабости синусового узла, для дальнейшего обследования переведен в городской эндокринологический стационар. При обследовании подтвержден АКТГ-зависимый гиперкортицизм (АКТГ 221,3 пг/мл (9,0-63,0), кортизол 09:00 ч 2041 нмоль/л (138-690)); манифестный тиреотоксикоз (ТТГ 0,02 мМЕ/л (0,3-4,0), свободный Т4 2,13 нг/дл (0,9-1,90)); сахарный диабет (колебания гликемии (плазма венозной крови) 9,99-11,52 ммоль/л). Обращала на себя внимание выраженная гипокалиемия (2,8 ммоль/л (3,5-5,0)) и лейкоцитоз до 11,7х10*9/л (<8,0). С целью исключения АКТГ-продуцирующей опухоли пациенту выполнена КТ органов грудной полости и надпочечников, на которой в S3 правого легкого обнаружено узловое образование 7х6 мм (рис. 2); данных за очаговый процесс в надпочечниках не получено.
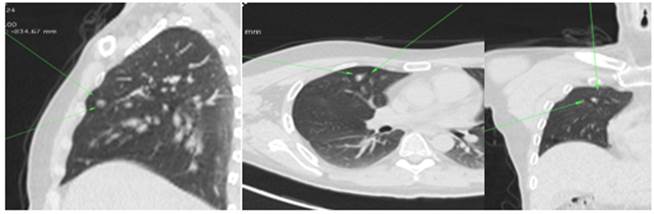
Рис. 2. Очаговое образование в S3 правого легкого при КТ органов грудной полости пациента С.
Для верификации диагноза пациент был направлен в Центр патологии надпочечников СЗГМУ им. И.И. Мечникова, где подтверждено нарушение циркадности секреции кортизола и АКТГ (АКТГ 09:00 ч 163 пг/мл (<46), 21:00 ч 165 пг/мл (<20); кортизол крови 09:00 ч 1116,0 нмоль/л (138-690), 21:00 ч 986,0 нмоль/л (70-345); кортизол слюны 23:00 ч 143,9 нмоль/л (<7,56)), существенное повышение экскреции кортизола с мочой (5146 мкг/сут. (20-65)). При выполнении пробы с 8 мг дексаметазона подавления продукции кортизола не достигнуто (кортизол 09:00 ч 868,0 нмоль/л (<50), суточная экскреция кортизола 3460 мкг/сут.). Существенно прогрессировала гипокалиемия (2,1 ммоль/л), гипопротеинемия (общий белок 52,0 г/л (65-85), альбумин 32,3 г/л (35-52)). Подтверждено наличие стероидной миопатии (пациент доставлен в клинику на каталке в связи с выраженной мышечной слабостью), стероидного сахарного диабета. Полученные клинико-лабораторные данные свидетельствовали о наличии АКТГ-зависимой формы эндогенного гиперкортицизма тяжелого течения с наиболее вероятным источником в очаговом образовании S3 правого легкого. Проводилась коррекция электролитных нарушений, назначен верошпирон (400 мг/сут.), назначена терапия кетоновыми аналогами аминокислот (кетостерил). С целью контроля гиперкортицизма использовали ингибиторы стероидогенеза (кетоконазол 400 мг/сут.). 20.10.22 г. проведен селективный забор крови из кавернозных синусов. В периферической вене АКТГ был повышен до 168 пг/мл (<46), при этом в нижнем каменистом синусе слева показатель составлял 194 пг/мл, а справа - 185 пг/мл. Отсутствие повышения градиента концентрации АКТГ синус/периферическая вена подтверждало внегипофизарную продукцию АКТГ.
Оставались сомнения в локализации источника гиперпродукции АКТГ. ПЭТ-КТ (10.10.2022 г.) с 18-фтордезоксиглюкозой (18F-ФДГ) не позволило визуализировать источник АКТГ-ЭС. В верхушках обоих легких определялись признаки метаболически активных изменений - интерстициальные фокальные уплотнения, накапливающие РФП, а также отмечено повышение гликолитической активности надпочечников. При повторных исследованиях 25.10.2022 г. (с 68GA-DOTATE) и 26.10.2022 г. (с 68GA-DOTA-NOC) в S3 правого легкого выявлено образование 10х8 мм, плотностью +33 HU, без гиперфиксации РФП (68GA-DOTATE и 68GA-DOTA-NOC-негативное образование) на фоне единичных участков пневмофиброза в обоих легких; а также картина диффузного утолщения обоих надпочечников. Высказано предположение, что рецепторы данной опухоли не чувствительны к 68GA-DOTATE и 68GA-DOTA-NOC-РФП.
Осмотрен торакальным хирургом, запланирована торакоскопическая атипичная резекция S3 правого легкого (тотальная биопсия новообразования) с гистологическим исследованием. При подготовке к операции на ультразвуковом исследовании вен нижних конечностей диагностирован дистальный тромбоз глубоких вен справа, инициирован прием антикоагулянтов (ксарелто 20 мг/сут.) и венотоников (детралекс 1000 мг/сут.).
В ноябре 2022 г. пациент госпитализирован в клинику госпитальной хирургии Военно-медицинской академии в плановом порядке. На момент поступления: жалобы на выраженную мышечную и общую слабость, сухость во рту, жажду, полиурию, эпизоды необоснованной тревоги, внутренней дрожи до 5-6 раз за сутки. При объективном осмотре обращало на себя внимание перераспределение подкожно-жировой клетчатки с избыточным отложением на лице и в области живота при нормальном ИМТ 23,4 кг/м2. Гемодинамика была стабильной (АД 110/70 мм рт. ст., пульс 72 в мин.). По данным спирометрии: обструктивных и рестриктивных нарушений не выявлено. Выполнена торакоскопическая атипичная резекция S3 правого легкого. По результатам гистологического и иммуногистохимического исследования: типичный карциноид S3 правого легкого с гиперсекрецией АКТГ и низкой пролиферативной активностью (Ki 67/MIB1 1-2%), G1 без опухолевого роста в краях резекции. ICD-0 code 8240/3, ICD-11 coding 2C25:4 и XH9LV8. Высокий уровень экспрессии MGMT (90% клеток опухоли), гиперэкспрессия рецепторов соматостатина 2 типа (SSTR2). Диффузное позитивное цитоплазматическое окрашивание опухолевых клеток (+++) CD56, АКТГ, Syn, хромогранин A. Позитивное ядерное окрашивание р53 (++) 1-3% опухолевых клеток, TTF1 (-). В послеоперационном периоде отмечалась существенная положительная клиническая динамика, купирование жалоб и нормализация общего состояния без необходимости приема медикаментов.
АКТГ-эктопический синдром относят к типичным паранеопластическим синдромам. Среди вариантов АКТГ-зависимого гиперкортицизма он представляет наибольшие трудности для диагностики. Несмотря на понятную клиническую картину гиперкортицизма, на ранних стадиях выявить опухоль практически не удается. Это связано как с необходимостью и доступностью полноценного комплексного обследования, так и с особенностями продукции опухолью гормонов и биологически активных веществ. Согласно литературным данным, наиболее частой причиной АКТГ-эктопического синдрома становятся нейроэндокринные опухоли (карциноид) легкого, что подтверждено рассмотренными клиническими случаями. Развитие клинической картины может быть как очень бурным (в течение нескольких месяцев), так и достаточно протяженным во времени (несколько лет). Клинический случай 1 иллюстрирует медленное развитие клиники гиперкортицизма, связанное не только с особенностями метаболической активности самой нейроэндокринной опухоли, но и с миграцией очага гиперпродукции адренокортикотропного гормона. Так, в период 2016-2018 гг. симптомы гиперкортицизма у пациентки были обусловлены активностью кортикотропиномы (наличие которой полностью подтверждают результаты селективного забора крови из нижних каменистых синусов), а с 2019 г. динамику развития клинических симптомов стала обеспечивать эктопическая гормональная активность карциноида легкого. Такое развитие заболевания у пациентки привело к значительным затруднениям при верификации диагноза, необходимости повторных стационарных обследований с использованием всех возможных современных диагностических методик. Клинический случай 2, напротив, демонстрирует типичное стремительное, в течение нескольких месяцев, развитие клиники тяжелого осложненного гиперкортицизма, требующего максимально быстрого обследования пациента. Своевременная диагностика зачастую оказывается возможной лишь в специализированных эндокринных центрах. Кроме необходимости серьезных инвазивных процедур (в частности, селективный забор крови из нижних каменистых синусов, позволяющий исключить гипофизарный характер гиперпродукции АКТГ), топическая диагностика нейроэндокринной опухоли требует применения (зачастую неоднократного) высокотехнологичных методик обследования. Позитронно-эмиссионная томография не всегда может дать ответы на поставленные клиницистами вопросы в связи с разнообразием клеточного состава и разной чувствительностью нейроэндокринных опухолей к радиофармпрепаратам. Радикальное хирургическое удаление опухоли является единственным эффективным методом лечения, позволяющим в более чем 70% случаев достичь ремиссии. В отличие от нейроэндокринных опухолей иных локализаций, при карциноиде легкого пациенты имеют более благоприятный прогноз, лучшую выживаемость и низкую частоту рецидивов. Однако тяжесть течения гиперкортицизма и его осложнений в некоторых случаях, при невозможности адекватного терапевтического контроля, требует дополнительных хирургических вмешательств (в частности, двусторонней адреналэктомии). Таким образом, крайне важна настороженность клинициста в плане АКТГ-эктопического синдрома при подтверждении у пациента АКТГ-зависимого гиперкортицизма. Кроме общепринятого алгоритма диагностического поиска необходимо проведение компьютерной томографии органов грудной полости для исключения очаговых образований, которые могут быть источником гиперпродукции АКТГ. Появление типичных лабораторных изменений (значительное повышение референса суточной экскреции кортизола и стойкая гипокалиемия) при соответствующих клинических проявлениях гиперкортицизма должны ориентировать клинициста на поиск очага эктопической продукции АКТГ.



