В последнее время увеличивается загрязнение воздуха различными химическими соединениями, что приводит к повсеместному ухудшению среды обитания человека. Это способствует возникновению патологий, связанных с экологическими нарушениями, появлению устойчивых штаммов возбудителей различных инфекционных заболеваний [1]. Поэтому приоритетным и актуальным остается выявление и изучение новых эффективных, экологически безопасных средств растительного происхождения, к которым относятся эфирные масла (ЭМ).
Эфирные масла способны оказывать бактерицидное, противовоспалительное, противоотечное, обезболивающее, спазмолитическое воздействие и издавна используются в ароматерапии, лечебной косметике [2]. Считается, что ЭМ не имеют негативного побочного влияния на организм и не вызывают привыкания. Тем не менее существуют ограничения по их использованию при ряде физиологических состояний (беременность) и отклонений (аллергии, заболеваниях сердечно-сосудистой, дыхательной, нервной и др. систем) [3]. В то же время научно обоснованных методик по расчету эффективных доз в ароматерапии не существует, а соответствующие рекомендации опираются преимущественно на органолептические показатели.
Основой различных патологий является окислительный стресс как дисбаланс образования и удаления свободнорадикальных метаболитов. Для гомеостаза в равной степени опасны как избыточная продукция свободных радикалов, так и чрезмерное торможение их образования. Поэтому информация об антиоксидантной или прооксидантной активности ЭМ, полученная хемилюминесцентным (ХЛ) методом, может служить одним из объективных критериев для скрининга, индивидуального и/или группового подбора и количественной оценки эффективности ароматерапии как самостоятельного и вспомогательного лечебного воздействия. С другой стороны, сочетание бактерицидной активности со свойством ЭМ образовывать нетоксичные комплексы с поллютантами позволяет использовать их для оздоровления воздушной среды в производственных помещениях и в местах большого скопления людей [4].
Для выяснения специфичности радикалотропных эффектов эфирных масел использовали два ХЛ-зонда, избирательно реагирующих с гидроксил-радикалом (люминол) и супероксид-анионрадикалом (люцигенин). Использование этих усилителей хемилюминесценции позволяет выяснить механизм действия эфирных масел в различных средах, что необходимо для оптимизации использования их для санации воздушной среды помещений и в качестве лечебно-профилактических средств.
Целью работы являлась оценка бактерицидной активности ЭМ в связи с их редокс-активностью в моделях люминол- и люцигенин-зависимой хемилюминесценции для рекомендаций по повышению эффективности адаптогенного применения эфирных масел.
В задачи исследования входило: 1) определение антиоксидантной активности ЭМ в моделях люминол- и люцигенин-зависимой хемилюминесценции; 2) определение влияния эфирных масел на жизнеспособность фагоцитарной активности; 3) сопоставление антиоксидантной и бактерицидной активности эфирных масел.
Объекты и методы исследования
Объектами исследования были коллоидные растворы эфирных масел сосны, эвкалипта, лимона и мяты в среде Хенкса в широком диапазоне концентраций (от 10-1 до 10-7 ‰) [5]. Антиоксидантная активность ЭМ изучалась методом хемилюминесцентного анализа по Tono-Oka e.a. (1983) с использованием разработанного в СКТБ «Наука» СО РАН серийного программно-аппаратурного комплекса, работающего в режиме счета фотонов и позволяющего изучать кинетику окислительных реакций, развивающихся под влиянием экзогенной стимуляции клеток крови или в ее отсутствие [6; 7]. В качестве источника свободных радикалов были использованы фагоцитирующие лейкоциты крови человека. Для исследования использовали неразделённую (цельную) капиллярную кровь (из пальца). Выделять фракцию фагоцитов не было необходимости, т.к. на их долю приходится не менее 70% популяции циркулирующих лейкоцитов. Получаемые микрообразцы периферической крови (из пальца, 100 мкл) десятикратно разбавляли внесением в пробирки-эппендорфы, содержащие 1 мл неокрашенной среды Хенкса. К пробам добавляли гепарин из расчета 20 ЕД/мл. Реакционную смесь готовили непосредственно перед измерением ХЛ-активности фагоцитов. В кварцевые кюветы вносили 200 мкл разогретого до 37 °С люминола, 100 мкл суспензии крови в среде Хенкса (1:10), 50 мкл рабочего раствора латекса и 50 мкл препарата. Длительность записи кинетики ХЛ-реакции составляла 90 минут [7].
Для определения бактерицидного потенциала эфирных масел использовались стандартные штаммы патогенных (Staphylococus aures штамм MRSA), условно-патогенных (Escherichia coli) бактерий и грамположительных энтеросимбионтов (Bifidobacterium). Определение бактерицидной активности эфирных масел основывалось на подавлении дегидрогеназной активности тест-культур в выбранной питательной среде [8].
Эффективность фагоцитарной модели оценивали по уровню свободных радикалов, продуцируемых в заданных условиях за фиксированный промежуток времени. По степени снижения продукции свободных радикалов в присутствии аналитов оценивали их антиоксидантный потенциал; по степени повышения продукции свободных радикалов относительно контрольного уровня делали вывод о прооксидантной активности препаратов.
Результаты статистически обрабатывались с помощью программы Statictica 6.0 и Excel Microsoft Office 2000. Достоверность различий экспериментальных, контрольных показателей и нормы оценивали с помощью непараметрического T-критерия Вилкоксона парных сравнений [9].
Результаты и их обсуждение
В реакционной среде использовали фагоциты крови людей с нормо- и гипопродуктивным типом функционального ответа. В рамках фагоцитарной модели рассматривали свободнорадикальную активность фагоцитов не только при их стимуляции латексом, но и в её отсутствие (базальные условия). Необходимо было оценить влияние эфирных масел на ферментативный аппарат фагоцитов, локализованный в их мембране, при отсутствии контактных антигенных раздражителей, т.е. в базальных условиях. Для исследования механизмов радикалотропного влияния на основании полученных ранее результатов были выбраны наиболее активные тушители стимулированной хемилюминесценции: ЭМ сосны, мяты, лимона, а в качестве сильного прооксиданта - эфирное масло эвкалипта.
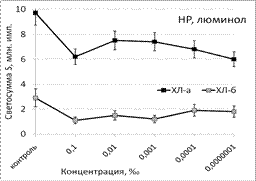
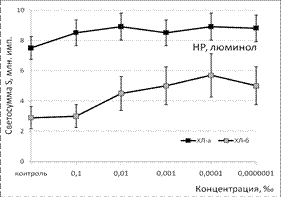
Эфирное масло сосны неселективно подавляло продукцию как первичных, так и вторичных радикалов, поскольку этот образец проявлял антиоксидантную активность независимо от условий эксперимента и уровня СР в реакционной системе (рис. 1).
|
|
|
|
|
|
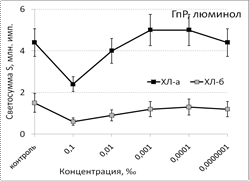
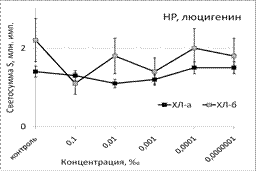
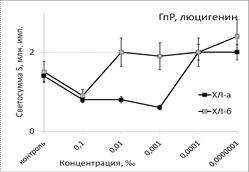
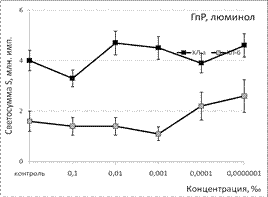
Рис. 1. Тушение хемилюминесценции стимулированных (ХЛа) и нестимулированных (ХЛб) фагоцитов при нормореактивном (НР) и гипореактивном (ГпР) типах ответа под влиянием ЭМ сосны в зависимости от концентрации; *p < 0,05 под контролем Т-критерия Вилкоксона.
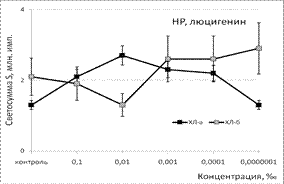
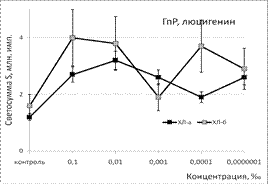
Под влиянием эфирного масла сосны светосумма активированной ХЛ при нормореактивном типе клеточной иммунореактивности (ХЛ-зонд - люминол) при концентрации 0,1‰ снижалась на величину от 37% (ХЛа) до 62% (ХЛб). При меньших концентрациях этот эффект ослабевал либо исчезал вовсе. Первая фаза наблюдалась при максимальной из рассмотренных концентраций. Повторный АО-эффект (вторую фазу) удалось наблюдать только при использовании гипореактивных фагоцитов, продуцирующих меньше свободных радикалов в реакционной системе. Антиоксидантные эффекты ЭМ сосны, наблюдаемые при использовании люцигенина - ХЛ-зонда, избирательного к супероксиданион-радикалу, имели тот же характер и концентрационную зависимость. Таким образом, ЭМ сосны обладает универсальным антиоксидантным влиянием на продукцию биогенных свободных радикалов, как первичных, гидрофобных (супероксиданион-), так и вторичных, гидрофильных (гидроксил-) радикалов.
На рисунке 2 представлена картина влияния эфирного масла эвкалипта на ХЛ-ответ фагоцитов при различных условиях активации и в присутствии радикал-специфичных ХЛ-зондов. Судя по полученным результатам, не только подтвердился прооксидантный характер влияния ЭМ эвкалипта на продукцию биогенных СР, но и проявилась радикал-направленная селективность этого влияния. При использовании ОН•-ХЛ-зонда люминола снижения активированной продукции СР нормореактивными фагоцитами не наблюдалось, а базальная продукция проявляла тенденцию к возрастанию (повышение на 16% при концентрации 0,0001‰). Таким образом, ЭМ эвкалипта влияло на продукцию агрессивных гидрофильных гидроксил-радикалов только как прооксидант, но не антиоксидант.
|
|
|
|
|
|
Рис. 2. Стимуляция хемилюминесценции стимулированных (ХЛа) и нестимулированных (ХЛб) фагоцитов при нормореактивном (НР) и гипореактивном (ГпР) типах ответа под влиянием ЭМ эвкалипта в зависимости от концентрации; *p < 0,05 под контролем Т-критерия Вилкоксона.
Иная картина была получена при использовании О2•-специфичного ХЛ-зонда люцигенина. Нарастание продукции данного вида радикалов наблюдалось во всех вариантах эксперимента - при использовании как нормо-, так и гипореактивных фагоцитов, а также при изучении как активированной, так и базальной ХЛ-кинетики. Под влиянием ЭМ эвкалипта генерация супероксида увеличивалась при активации фагоцитов в 2,6 раза, в базальных условиях - в 2,5 раза, т.е. практически так же. Прооксидантный эффект, усиленный люцигенином, был выражен на большей части исследованного интервала концентраций (1%, 0,01% и 0,001%). Таким образом, под влиянием ЭМ эвкалипта достоверно нарастала продукция гидрофобных супероксиданион-радикалов. Это вид активных форм кислорода, значительно менее агрессивных, первичных по отношению к ОН•, способных к образованию в воздушной среде [7].
Под влиянием ЭМ лимона в присутствии ХЛ-зонда люминола продукция свободных радикалов достоверно снижалась как при стимулированной, так и базальной активности фагоцитов. При использовании ХЛ-зонда люцигенина показатели светосуммы значимо не изменялись. Таким образом, ЭМ лимона - это гидрофильный антиоксидант, специфично взаимодействующий с гидроксильными радикалами и не влияющий на содержание в среде их предшественника - супероксиданион-радикала. Радикал-направленные эффекты ЭМ мяты противоположны таковым, полученным для ЭМ лимона. При использовании люминола значимого влияния на уровень продукции СР не отмечено. В то же время мощное тормозящее влияние на ХЛ как нормореактивных, так и гипопродуктивных фагоцитов (снижение продукции СР в 3-9 раз) было обнаружено в присутствии люцигенина. Следовательно, данный вид эфирного масла является гидрофобным антиоксидантом за счёт избирательного взаимодействия с супероксиданион-радикалами.
Для ответа на вопрос, не истощается ли функциональный потенциал фагоцитов под влиянием эфирных масел, был проведен следующий эксперимент. Результаты эксперимента представлены на рисунке 3.
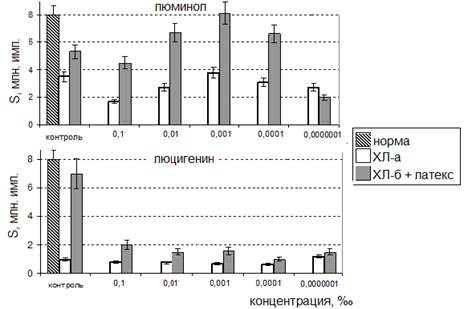
Рис. 3. ХЛ-ответ фагоцитов после воздействия эфирного масла сосны различных концентраций при стимуляции «дыхательного взрыва»с использованием ХЛ-зондов различной специфичности.
После записи кинетограмм ХЛ-ответа нестимулированных фагоцитов под влиянием ЭМ сосны реакционную смесь инкубировали в течение 90 минут с добавлением латекса. Если бы фагоциты потеряли жизнеспособность, то они оказались бы неспособными к «дыхательному взрыву» в результате стимуляции латексом, и при записи повторной кинетограммы светосумма была бы резко снижена. В противном случае, если функциональный потенциал фагоцитов не истощается под влиянием ЭМ, светосумма должна прирастать.
Клетки сохраняют свою жизнеспособность и отвечают генерацией активных форм кислорода на воздействие антигена независимо от вида используемого ХЛ-зонда. После воздействия эфирного масла стимулированные фагоциты, как и интактные клетки, остаются способными генерировать как первичные свободные радикалы (супероксиданион-радикал), так и вторичные (гидроксил-радикал), образующиеся из первичных в ходе спонтанных и/или ферментативных процессов (рис. 3). Следовательно, воздействие эфирного масла не приводит к нарушению хода функционально-метаболических процессов фагоцитарной клетки, продуцирующей радикалы. Таким образом, феномены радикалотропного влияния эфирных масел не являются артефактами, а отражают адаптивные компенсаторно-приспособительные реакции живой клетки.
Для определения антимикробной активности ЭМ в качестве тест-объектов были выбраны условно-патогенные микроорганизмы Escherichia coli, патогенные микроорганизмы Staphylococus aures штамм MRSA и грамположительные анаэробные бактерии-энтеросибионты Bifidobacteriaceae. Для раздельной оценки бактериостатических (рост-тормозящих, обратимых) и бактерицидных (устойчивых, необратимых) эффектов анализировали минимальную подавляющую концентрацию (МПК) ЭМ (100%) через час и спустя 15 часов после начала инкубации с микробной суспензией. При этом ключевой задачей являлось выявление связи показателей антимикробной и антирадикальной способности масел для разработки рекомендаций по использованию результатов ХЛ-анализа антиоксидантного потенциала ЭМ в прогнозе бактерицидной эффективности. Полученные результаты представлены в таблице 1.
Таблица 1 - Бактериостатическая и бактерицидная активность эфирных масел
|
№ п/п |
Вид ЭМ
|
Антимикробная активность ЭМ, МПК (мг/мл) |
||||
|
Escherichia coli |
Staphylococus aures штамм MRSA |
Bifidobacteriaceae |
||||
|
1 ч |
15 ч |
1 ч |
15 ч |
1 ч |
||
|
1. |
Сосна |
82,70 |
82,70 |
1,29 |
10,33 |
82,7 |
|
2. |
Мята |
8,62 |
17,25 |
2,15 |
8,62 |
0,27 |
|
3. |
Лимон |
40,10 |
80,20 |
0,16 |
20,05 |
5,01 |
|
4. |
Эвкалипт |
42,90 |
42,90 |
10,72 |
21,45 |
3,68 |
Результаты свидетельствуют о неодинаковом характере влияния эфирных масел на тест-культуры различной патогенности. В отношении E. coli максимальной бактериостатической активностью и бактерицидностью характеризовалось ЭМ мяты (МПК = 8,62 мг/мл и 17,25 мг/мл). В отношении MRSA максимальной бактериостатической активностью характеризовалось ЭМ лимона (МПК = 0,16 мг/мл), а максимальной бактерицидностью - ЭМ мяты (8,62 мг/мл). В отношении Bifidobacteriaceae максимальной бактериостатической активностью характеризовалось ЭМ мяты (МПК = 0,27 мг/мл).
Заключение
Против патогенных микроорганизмов наиболее эффективными оказались гидрофобные антиоксиданты. Использование ЭМ мяты, высокоэффективного против патогенов, может быть небезопасно для энтеросимбионтов, что особенно актуально для использования ЭМ мяты, имеющего пищевое значение. Эфирные масла, обладающие свойствами гидрофильных антиоксидантов (ЭМ лимона и сосны) и способные взаимодействовать как с супероксиданион-радикалом, так и с гидроксил-радикалом, слабо влияли на условно-патогенную микрофлору. Проявление антимикробной активности ЭМ мяты в отношении Е.coli, по-видимому, связано с антиоксидантной активностью против гидрофобных радикалов, в частности супероксиданион-радикала.
Рецензенты:
- Щур Л.А., д.б.н., старший научный сотрудник Института вычислительного моделирования СО РАН, г. Красноярск.
- Тиранен Л.С., д.б.н., ведущий научный сотрудник Международного научного центра исследований экстремальных состояний организма при Президиуме КНЦ СО РАН, г. Красноярск.