Введение
Современные тенденции развития микробиологии включают, наряду с совершенствованием традиционных методов, активное использование молекулярно-биологических подходов для изучения генетических особенностей микроорганизмов. Многие исследователи используют методы ПЦР и системы олигонуклеотидных праймеров для определения микроорганизмов до вида с помощью амплификации генов отдельных микроорганизмов, например, для определения цианобактерий [12, 2, 8].
В настоящее время внимание исследователей привлекают микроорганизмы-индикаторы состояния почвенных экосистем при воздействии на них различных поллютантов. В микробиологическом мониторинге исследователи часто используют бактериальные культуры, рост и развитие которых находится в зоне оптимума, т.е. требуют благоприятных условий почвенной среды. К таким чувствительным формам (индикаторам) относится Azotobacter chroococcum, который можно обнаружить только в высоко плодородных почвах с оптимальными для развития растений условиями [7, 5, 9].
Целью настоящей работы явилось определение нуклеотидных последовательностей генов двух штаммов Azotobacter, выделенных из почв г. Алматы, с помощью системы праймеров, позволяющей амплифицировать участки генов, достаточные для идентификации микроорганизмов до вида.
Для достижения указанной цели были поставлены следующие задачи: 1) выделить из почвенных образцов г. Алматы свободноживущие азотфиксирующие бактериальные штаммы и идентифицировать их до рода; 2) с помощью праймеров определить нуклеотидные последовательности генов двух штаммов Azotobacter, позволяющие амплифицировать участки этих генов, достаточные для идентификации микроорганизмов; 3) определить эти штаммы до вида на основе анализа структуры генов.
Объекты и методы исследования
Использованные сокращения: ДНК - дезоксирибонуклеиновая кислота, pРНК - рибосомная рибонуклеиновая кислота, ПЦР - полимеразная цепная реакция, дНТФ - дезоксирибонуклеозидтрифосфаты, ТАЕ буфер - буферный раствор, содержащий смесь Трис-HCl, уксусной кислоты и ЭДТА (этилендиаминтетрауксусная кислота), п.н. - пара нуклеотидов, GenеBank - база данных, содержащая последовательности ДНК и расположенная на сервере Национального центра биотехнологической информации США.
Штаммы и условия культивирования. Для определения видовой принадлежности использовали 2 штамма (2 изолята) азотфиксирующих микроорганизмов рода Azotobacter, которые выделили из почв г. Алматы, загрязненных тяжелыми металлами (ТМ) [4]. Клетки штаммов Azotobacter культивировали при 28-31 °С на твердой безазотистой среде Эшби для изучения их морфологических и физиологических характеристик [2], а также для выделения единичных колоний при проведении ПЦР-анализа.
Выбор праймеров. Был проведен поиск нуклеотидных последовательностей геномов Azotobacter в международной базе данных, содержащей последовательности ДНК (GeneBank). Процедуру элаймента проводили с помощью программы BioEdit Sequence Aligment Editor. На основании результатов были выбраны консервативные участки последовательностей гена Azotobacter.
Таблица 1. Нуклеотидные последовательности праймеров
|
Праймер |
Последовательность (5′-3′) |
|
16s rRNA (forward - 8f) |
5′-AgAgTTTgATCCTggCTCAg-3′ |
|
16s rRNA (revers - 806R) |
5′-ggACTACCAgggTATCTAAT-3′ |
Выделение геномной ДНК. Геномную ДНК выделяли по методу R.Boom и др. [9], согласно протоколу Miniprep (Promega, USA) c использованием в качестве хаотропного агента буфер с гуанидин-тиоцианатом, в состав которого входили: 120 г гуанидин-тиоционата, 2,6 г тритон Х-100, 100 мл 0,1 М Трис-HCl (рН 6,4 при 65°С), 22 мл 0,2М ЭДТА (рН 8,0). В качестве сорбента был использован диоксид кремния, забуференный соляной кислотой. В состав первого промывочного буфера входило 120 г гуанидин-тиоционата в 100 мл Трис-HCl (рН 6,4, 65°С). В качестве отмывочного буфера от хаотропного агента был использован 70 % этанол. Данная серия отмывок позволила избавиться от ингибиторов и клеточных элементов и на выходе получить достаточно чистые нуклеиновые кислоты (ДНК/РНК), которые были использованы в ПЦР.
Концентрацию выделенных ДНК измеряли спектрофотометрическим методом на NanoDrop 1000 при длине волны 260 нм. РНК в препаратах присутствовал в следовых количествах (менее 1 % по электрофоретическим данным).
ПЦР-амплификация. Реакционная смесь (20 мкл) содержала: 150 нг ДНК, 1Ед. Maxima Hot Start Taq DNA Polymerase (Fermentas), 0,2 mM каждого дНТФ, 1-х ПЦР буфер (Fermentas), 2,5 mM MgCl2, 10 pmol каждого праймера.
Программа ПЦР-амплификации включала денатурацию 95 °С в течение 5 мин; 30 циклов: 95 °С - 20 секунд, 55 °С - 30 сек, 72 °С - 1 минута; заключительная элонгация 10 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Bio-Rad DNA Engine Tetrad2 peltier thermal cycler (Bio-Rad).
После амплификации продукты ПЦР для детекции ампликонов ДНК разделяли электрофорезом в 2 % геле агарозы, при толщине полиакриламидного геля 0,19 мм. Визуализацию полос осуществляли в УФ в присутствии бромистого этидия с помощью гель-документирующей системы производства Bio-Rad.
Очистку ПЦР продуктов от несвязавшихся праймеров проводили ферментативным методом, используя Exonuclease I (Fermentas) и щелочную фосфатазу (Shrimp Alkaline Phosphatase, Fermentas) [10].
Реакцию секвенирования проводили с применением BigDye® Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems) согласно инструкции производителя, с последующим разделением фрагментов на автоматическом генетическом анализаторе 3730xl DNA Analyzer (Applide Biosystems).
Нуклеотидные последовательности 16S rRNA гена идентифицируемых штаммов были анализированы с помощью программного обеспечения SeqScanner v1.0 и SecMan (Applide Biosystems и Laser Gene 6). Филогенетическое древо строили с помощью программного обеспечения MEGA 3.1 [9], выравнивание нуклеотидных последовательностей проводили, используя алгоритм ClustalW, построение филогенетических деревьев проводили с использованием метода ближайших соседей (Neiighbor-Joining NJ).
Результаты и обсуждение
Штаммы Azotobacter выделяли из 50 образцов почв г. Алматы. Ранее нами было показано, что азотфиксирующая культура Azotobacter обладала индикаторными свойствами на присутствие тяжелых металлов в почвах г. Алматы и была установлена степень токсичности отдельных почвенных образцов: транспортные и индустриальные урбаноземы со значительным содержанием ТМ (Pb - 50,3±3,3 мг/кг, Cd - 0,5±0,04 мг/кг, Cu - 43,9±2,7 мг/кг, Zn - 59,8±5,6 мг/кг) имели минимальную численность колоний аэробных азотфиксирующих бактерий с минимальными размерами их диаметра. Количество колоний уменьшилось на 35-46 % по сравнению с фоновой почвой, взятой за городом. Полученные результаты свидетельствовали о достаточно низкой степени распространенности Azotobacter в городских почвах (урбаноземах), более лучшие условия существования в фоновых почвах за счет обогащения органическим субстратом способствовали увеличению популяций Azotobacter.
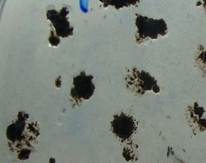

а б
Рисунок 1. Количество КОЕ Azotobacter вокруг почвенных частиц урбаноземов (а) и фоновой (б)
В ходе работы были выделены 2 штамма (изолята). Первичную идентификацию бактериальных штаммов проводили на основании изучения их морфолого-культуральных и физиолого-биохимических свойств. Установлено, что выделенные штаммы оказались мезофильными: росли при температуре 20-30°C. Предварительно они были отнесены к роду Azotobacter. На плотной среде Эшби штаммы 1 и 2 на 2-е сутки культивирования колонии на 2-е сутки были маленькими (0,1-0,4 мм в диаметре), на 4-6 сутки достигали 0,5-3,0 мм, форма колоний приподнятая, округлая, края ровные, гладкие, маслянисто-блестящие, беловатые, полупрозрачные, сильно ослизненные. Желатину не разжижали. Штаммы оказались не лизогенными, после хранения на плотных средах в течение 2-3 недель негативных пятен не обнаружено. При выращивании на плотных средах на 4-7 сутки обнаружен сплошной рост по штриху в виде выпуклых слизистых образований. На 5-е сутки их культивирования происходило образование коричневого пигмента. Оба штамма отличались по культуральным признакам. У культуры Azotobacter, шт.1 формировались колонии значительно меньшего размера, правильной округлой формы, сильно слизистые, растекающиеся колонии, форма колоний приподнятая, край и поверхность - гладкие, консистенция - клейкая. Культура Azotobacter, шт.2 образовывала плоские, достаточно крупные колонии неправильной округлой формы. Клетки выделяли очень мало слизи. Уже на 3-и сутки культивирования наблюдалось образование коричневого пигмента. Таким образом, комплекс фенотипических признаков по Берги [1] позволил предположить, что выделенный штамм 1 относится к виду Azotobacter chroococcum.
Чистую культуру выводили путем последовательных пересевов до единичной колонии в течение 7 дней при 29 °С. Полученные препараты ДНК чистой культуры двух штаммов имели концентрацию от 34,45 до 261,27 нг/мл из 12 повторностей по 6 на каждый штамм.
Таблица 1. Концентрация ДНК культуры Azotobacter
|
№ образцов |
Наименование |
Концентрация, нг/мл |
A260 |
A280 |
260/280 |
|
1 |
Шт.1/протокол 1 |
167,31 |
3,346 |
2,018 |
1,86 |
|
2 |
Шт.1/протокол 1 |
41,40 |
0,828 |
0,312 |
2,05 |
|
3 |
Шт.1/протокол 1 |
49,40 |
0,988 |
0,389 |
2,14 |
|
4 |
Шт.1/протокол 2 |
205,12 |
4,102 |
1,978 |
2,07 |
|
5 |
Шт.1/протокол 2 |
93,70 |
1,874 |
1,191 |
1,87 |
|
6 |
Шт.1/протокол 2 |
48,13 |
0,963 |
0,509 |
1,89 |
|
7 |
Шт.2/протокол 1 |
125,05 |
2,501 |
1,197 |
2,09 |
|
8 |
Шт.2/протокол 1 |
261,27 |
5,225 |
2,456 |
2,13 |
|
9 |
Шт.2/протокол 1 |
33,86 |
0,677 |
0,349 |
1,94 |
|
10 |
Шт.2/протокол 2 |
155,46 |
3,109 |
1,449 |
2,15 |
|
11 |
Шт.2/протокол 2 |
56,29 |
1,126 |
0,5 |
2,25 |
|
12 |
Шт.2/протокол 2 |
34,45 |
0,689 |
0,360 |
1,91 |
Как видно из таблицы 1, высокую концентрацию ДНК с хорошей чистотой наблюдали во всех 12 образцах при длине волны 260/280 с вариациями от 1,83 до 2,26. Для дальнейшей работы было отобрано по 3 образца каждого штамма с наибольшей концентрацией (№ 1, 4, 5 шт.1; № 6,7, 10 шт.2).
Далее провели электрофорез для детекции ДНК. На электрофореграмме отчетливо видны «бэнды» у 2 штаммов, что свидетельствовало о наличии их во всех образцах ДНК (рис.2).
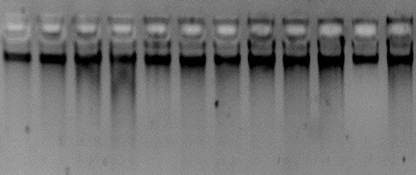
Рисунок 2. Электрофореграмма выделенных ДНК 12 образцов
После электрофореза провели ПЦР-амплификацию с универсальными праймерами 8f-5′-AgAgTTTgATCCTggCTCAg-3′ и 806R - 5′-ggACTACCAgggTATCTAAT-3′ для увеличения количества необходимого фрагмента ДНК. Повторный электрофорез для количественного определения фрагментов ДНК позволил нам получить участок ДНК длиной 798 п.н. (рис.3).
1 2 3 4 5 6 7 8 9 10 11 12 М

Рисунок 3. Электрофорерограмма ПЦР продуктов амплификации фрагмента 16S rRNA гена ДНК
Обозначения: Образцы, нумерация согласно номера штамма; (М) маркер молекулярного веса (Fermentas) (100 - 10000 п.н., от 100-1000 шаг 100 п.н.)
После очистки полученных фрагментов ДНК ферментативным методом провели реакцию секвенирования для прочтения нуклеотидной последовательности. В результате определили, что нуклеотидные последовательности образцов 1-3 (рис.3), относящиеся к Azotobacter, шт.1, имели высокую чистоту и визуализацию. Остальные образцы оказались малоинформативными.
Нуклеотидные последовательности из 1-3 образцов были объединены в общую последовательность ДНК в программном обеспечении SecMan, из которой позже были удалены концевые фрагменты (нуклеотидные последовательности праймеров, фрагменты, имеющие низкий показатель качества). Это позволило нам получить нуклеотидную последовательность протяженностью 579 п.н., которые были идентифицированы в GeneBank по алгоритму BLAST. Были отобраны следующие образцы ДНК Azotobacter 1f, 2f и 3f (forward primer). Получена 99 % гомология с депонированными последовательностями ДНК, что позволило отнести данный штамм к Azotobacter chroococcum.
Таким образом, молекулярно-генетическими методами было подтверждено, что Azotobacter, шт.1 можно отнести к Azotobacter chroococcum по фрагментам ДНК гена 16S rRNA размером 579 п.н., полученные методом ПЦР.
Полученные данные (в 3 повторностях) мы использовали для филогенетического анализа микроорганизмов Azotobacter chroococcum, шт.1. На рис. 4 представлено филогенетическое дерево, на котором исследуемые нами образцы по фрагменту 16S rRNA объединены в один кластер Azotobacter chroococcum, что свидетельствует об их идентичности.
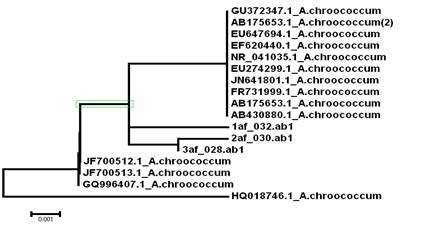
Рисунок 4. Филогенетическое дерево, построенное на основании анализа фрагмента гена 16S rRNA группы Azotobacter chroococcum
Заключение
Показана зависимость численности КОЕ азотобактера от степени загрязнения почв г. Алматы ТМ: наибольшая численность установлена для фоновой почвы (88 %), для урбаноземов она составила от 42 до 53 %. Следовательно, бактерии, относящиеся к роду Azotobacter, обладают индикационными свойствами по отношению к ТМ.
Нами выделено и идентифицировано 2 штамма бактерий рода Azotobacter. На основе анализа генетических характеристик один из них был отнесен к Azotobacter chroococcum. При идентификации в Gene Bank нуклеотидные последовательности 16S rRNA этого штамма имели максимальную идентичность с Azotobacter chroococcum (99 % гомологии).
Работа выполнена при финансовой поддержке грантов КазНПУ им. Абая в области фундаментальных и прикладных исследований 2011 г. (договоры № 1 и 59).
Рецензенты:
- Жуматов К.Х., д.б.н., профессор, заведующий лабораторией экологии вирусов Института микробиологии и вирусологии КН МОН РК, г. Алматы.
- Кушугулова А.Р., д.м.н., ст. науч. сотр. Департамента трансляционной медицины, долголетия и глобального здоровья Университета им. Н.А. Назарбаева, г. Астана.



