Эффективность сохранения генофонда растений ex situ может быть резко повышена путем создания генетических банков растений. По классификации Международного центра генетических ресурсов различают следующие виды генетических банков: 1) генные банки семян; 2) полевые генные банки (специальные, обычно клоновые посадки растений); 3) банки меристем - хранение растительного материала в условиях in vitro (культура изолированных меристем, тканей и органов растений в условиях замедленного роста) [1].
Разработка методов микроклонального размножения является основой для создания генетических банков in vitro редких и исчезающих видов растений, а также одним из перспективных направлений сохранения биоразнообразия в целом. Ботанические сады являются важными центрами по реализации программ изучения, сохранения и воспроизводства ценных и редких видов растений, занесенных в Красные книги.
Целью нашей работы является создание наиболее репрезентативной коллекции редких и исчезающих видов растений в культуре in vitro. На ее базе осуществлялся подбор оптимальных условий культивирования растений, изучалось проявление генотипических особенностей видов в культуре in vitro, проанализирована возможность использования методов биотехнологии для сохранения и воспроизведения редких и исчезающих видов растений.
Материалы и методы
Объектом наших исследований послужила коллекция in vitro редких и исчезающих видов растений ГБУ ВО «Волгоградский региональный ботанический сад», которая насчитывает на данный момент 72 вида, относящихся к 25 семействам.
В работе придерживались принятых на кафедре сельскохозяйственной биотехнологии МСХА методик приготовления и стерилизации питательных сред, инструментов и оборудования [4].
При оптимизации технологии клонального микроразмножения в качестве первичных эксплантов использовали семена, апикальные меристемы и пазушные почки регенерантов, сегменты луковиц, изолированные зародыши. На этапе введения в культуру отрабатывали различные приемы стерилизации. В ходе эксперимента изучали зависимость жизнеспособности эксплантов от срока их изоляции.
Для культивирования регенерантов на стадии пролиферации использовали минеральную основу питательной среды MS [8] в сочетании с агаром и сахарозой. В качестве регуляторов роста в питательную среду добавляли: кинетин 0,5; 1,0; 2,5; 5,0 мг/л; 6-бензиламинопурин (БАП) 0,1-0,7; 1,0; 2,5; 5 мг/л, тидиазурон, зеатин, 6-БАП рибозид и комбинации этих препаратов с 3-индолилуксусной кислотой (ИУК).
На стадии укоренения в качестве фитогормонов использовали: β-индолил-3-масляную кислоту (ИМК); 3-индолилуксусную кислоту (ИУК) в концентрациях 0,1-1 мг/л.
Адаптация регенерантов проводилась с применением пищевой полиэтиленовой пленки, с постепенным ее перфорированием, затем растения переносили в теплицу для доращивания [3; 7].
Результаты и обсуждение
Формирование и комплексное изучение коллекции редких и исчезающих видов растений в Волгоградском региональном ботаническом саду ведется с 2005 года. В настоящее время коллекционный фонд in vitro ГБУ ВО «ВРБС» насчитывает 72 редких вида, принадлежащих к 25 семействам.
Максимально представлены в коллекции семейства: Iridaceae - 20,8%, включает 15 представителей этого семейства; Fabaceae - 16,7% (12 видов); Asteraceae - 15,3% (11 видов); Liliaceae - 6,9% (5 видов); Brassicaceae - 5,6% (4 вида); Caryophyllaceae - 5,6% (4 вида); Paeoniaceae - 2,8% (2 вида); Papaveraceae - 2,8% (2 вида). Остальные семейства представлены в коллекции менее 2% и только по одному представителю из семейства.
Объектами исследования являлись виды разных семейств и жизненных форм: прямостоячие кустарники (Calophaca wolgarica, Genista tanaitica), полукустарнички (Lepidium meyeri, Silene cretacea, Hedysarum cretaceum), стержнекорневые травянистые поликарпики (Matthiola fragrans, Hedysarum grandiflorum, Astragalus dasyanthus), короткокорневищные травянистые поликарпики (представители рода Iris), луковичные и клубнелуковичные поликарпики (Bellevalia sarmatica, Allium regelianum, Tulipa gesneriana).
По эколого-фитоценотическим группам выделяются: лугово-степные (Iris aphylla), степные (Bellevalia sarmatica, Calophaca wolgarica, Astragalus dasyanthus, Iris pumila), галофитно-лугово-степные (Allium regelianum), петрофильно-степные (стенотопные виды - кальцефиты Hedysarum cretaceum, Lepidium meyeri, Matthiola fragrans, Silene cretacea).
Основная часть коллекции (44 вида) занесена в Красную книгу Российской Федерации [5]. В наших исследованиях представлены виды разных категорий редкости. 0 категория (исчезнувшие виды) составляет 2,3% и представлена 1 видом - Gladiolus palustris Gaudin. 1 категория (виды, находящиеся под угрозой исчезновения) насчитывает 8 видов, что составляет 18,2%. 17 редких и исчезающих видов растений относятся ко 2 категории (уязвимые виды) (38,6%). Наибольшее число видов (18) включает в себя 3 категория (редкие виды).
В качестве первичных эксплантов для введения в культуру in vitro при работе с редкими и исчезающими видами растений использовали: семена (Lepidium meyeri, Matthiola fragrans, Silene cretacea, Hedysarum Razoumovianum), апикальные меристемы и пазушные почки регенерантов (Hedysarum cretaceum, Hedysarum grandiflorum, Clematis integrifolia, Clematis orientalis, Clematis recta), сегменты луковиц (Bulbocodium versicolor), изолированные зародыши (Gladiolus tenuis).
В результате проведенных экспериментов был подобран оптимальный режим стерилизации - помещение семян и сегментов луковиц после спирта в 5-7%-ный раствор лизоформина на 10 минут, для растительных тканей: 1-3%-ный раствор лизоформина с временной экспозицией 5-7 минут. При использовании таких методик стерилизации был получен максимальный выход жизнеспособных эксплантов, для разных видов он варьировал в пределах 70-95%.
Экспериментально установлено, что наиболее благоприятными сроками для введения в культуру in vitro растительных тканей редких и исчезающих видов является начальная стадия вегетации.
На этапе микроразмножения и укоренения in vitro осуществлялся подбор оптимальных концентраций ауксинов и цитокининов. Изучалось их влияние на динамику развития регенерантов, коэффициент размножения, ризогенез и определялась оптимальная продолжительность пассажа.
Отчетливо проявлялись видовые особенности, что выражалось в различном количестве дополнительно заложенных почек и развивающихся из них побегов. В некоторой степени особенности культивирования разных видов отражают эндогенное содержание ростовых веществ, которое является генетически обусловленным [2].
Коэффициент размножения изученных генотипов варьировал от 2 до 17,4. Его колебания в зависимости от генотипических особенностей были существенны и отличались более чем в 8 раз. Наибольшей способностью к регенерации характеризовались представители семейства Fabaceae (Lepidium meyeri, Matthiola fragrans ) и Caryophyllaceae (Silene cretacea).
Как было установлено, на коэффициент размножения оказывали влияние не только генетические особенности. Для поддержания устойчиво пролифелирующей культуры in vitro весьма существенным является правильный подбор и оптимальные соотношения регуляторов роста (цитокининов и ауксинов). В процессе исследования были выявлены наиболее оптимальные концентрации экзогенных гормонов на стадии размножения (табл.1).
Таблица 1 - Влияние концентрации БАП и ИУК на коэффициент размножения Lepidium meyeri
|
БАП (мг/л) |
Концентрация ИУК (мг/л) |
||||||
|
0 |
0,1 |
0,3 |
0,5 |
0,7 |
0,9 |
1,0 |
|
|
0 |
1,1 ± 0,1 |
1,1 ± 0,1 |
1,1 ± 0,1 |
1,1 ± 0,1 |
1,1 ± 0,1 |
1,1 ± 0,1 |
1,1 ± 0,1 |
|
0,1 |
5,4 ± 0,3 |
4 ± 0,3 |
4 ± 0,3 |
7,6 ± 0,5 |
5,4 ± 0,3 |
3,2 ± 0,3 |
4,6 ± 0,3 |
|
0,5 |
8,4 ± 0,6 |
12 ± 0,3 |
6,8 ± 0,7 |
43,2±1,9 |
12,4±0,5 |
5 ± 0,4 |
9,2 ± 0,4 |
|
1,0 |
17,4 ±0,9 |
12,4 ± 0,6 |
19,6±0,8 |
19,4±0,8 |
29,4±1,1 |
4,6 ± 0,3 |
32,4±0,4 |
|
2,5 |
35 ± 1,0 |
14,4 ± 0,8 |
2,8 ± 0,2 |
31,8±0,9 |
16,4±0,5 |
11,8±1,2 |
19,8±0,6 |
|
5,0 |
7,8 ± 0,5 |
34,8 ± 1,3 |
- |
22,6±1,0 |
- |
- |
33,8±0,6 |
В результате исследования совместное использование БАП и ИУК в большинстве случаев не оказывало существенного положительного влияния на коэффициент размножения по сравнению с использованием одного БАП. Максимальный коэффициент размножения был на среде, содержащей БАП в концентрации 2,5 мг/л. Но увеличение концентрации с 1 до 2,5 мг/л для большинства видов приводило к увеличению не только коэффициента размножения, но и к образованию витрифицированных побегов, которые впоследствии характеризовались пониженной способностью к укоренению. Дальнейшее увеличение концентрации БАП до 5 мг/л приводило к 100%-ной витрификации регенерантов. Таким образом, оптимальная концентрация БАП на этапе микроразмножения с учетом совокупности данных по относительному приросту регенерантов и каллусогенезу составляет 0,5-1мг/л.
Экспериментально доказано, что темпы развития эксплантов при культивировании разных видов существенно различаются. Так, если для Lepidium meyeri и Matthiola fragrans (представителей семейства Brassicaceae) коэффициент размножения был намного выше на этапе введения в культуру и при первых субкультивированиях, то для представителей семейства Fabaceae (Hedysarum grandiflorum, Hedysarum cretaceum) вырисовывается другая картина. Максимальный коэффициент размножения приходился на 4-6 пассаж. Волнообразный график показаний представлен на рисунке 1.
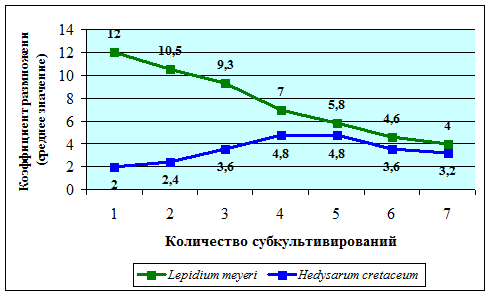
Рис. 1. Сравнение темпов развития Lepidium meyeri и Hedysarum cretaceum в зависимости от количества субкультивирований.
Результаты экспериментов по подбору сред на этапе укоренения показывают значительные отличия скорости укоренения в зависимости как от генетических особенностей редких и исчезающих видов, так и от концентрации ауксинов, применяемых для индукции ризогенеза.
Были изучены различные концентрации ИУК (от 0,1 до 1,0 мг/л) и ИМК (0,5; 1,0; 2,5; 5,0 мг/л). Укореняемые побеги Lepidium meyeri высаживали на питательные среды, минеральную основу которых составляла полная и разбавленная вдвое модифицированная среда Мурасиге-Скуга с добавлением 20 г/л сахарозы, 6,5 г/л агара и набора витаминов, как в основной среде.
Анализируя полученные данные, выявлено, что через 20 дней после помещения побегов на питательную среду наибольший процент корнеобразования наблюдается на вариантах с полной минеральной основой среды МС и концентрацией ИУК от 0,2 до 1,0 мг/л. На разбавленной среде количество растений с корнями было меньше. Впоследствии происходит процесс сглаживания как по количеству растений с корнями, так и по характеру корнеобразования (количество, длина корней, количество растений с корнями второго порядка).
Для Clematis integrifolia и Clematis recta оптимальной оказалась питательная среда, содержащая ИУК в концентрации 0,5 мг/л, при этом процент укорененных растений составил 90 и 84% соответственно (рис. 2). Для Clematis orientalis лучшие показатели отмечены на среде, содержащей ИМК в концентрации 1 мг/л. При этом процент укорененных растений составил 95%. Увеличение концентрации ауксинов до 3 мг/л приводило к образованию каллуса, при этом побеги были нитевидные, витрифицированные, листья бледные, маленькие.
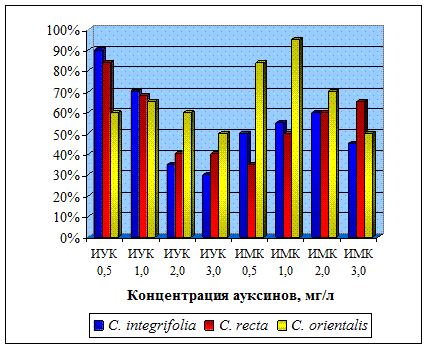
Рис. 2. Влияние ауксинов на процесс ризогенеза микрочеренков клематисов.
Наиболее ответственным моментом при клональном микроразмножении любой культуры является перенос растений в нестерильные условия, т.е. высадка их в почвенный субстрат. Именно на данном этапе отмечается наибольший процент гибели пробирочных растений [6].
Адаптацию регенерантов проводили при t=25 °C, освещенности 3 клк, влажности воздуха 70%. В качестве субстрата использовали смесь: торф; песок; дерновая земля (1:1:2). Растения высаживали в контейнеры емкостью 0,2 л. Для снижения влажности использовали пищевую пленку с постепенным ее перфорированием. Выход адаптированных растений составлял 70-90%. Затем адаптированные растения переносили в теплицу для доращивания.
Разработка технологии клонального микроразмножения редких и исчезающих видов растений с целью сохранения и размножения в культуре in vitro в основном завершена, однако дополнительные исследования продолжаются и будут вестись в направлении оптимизации этапов микроразмножения и укоренения в отношении генотипов, неустойчивых в культуре in vitro.
В результате исследований было установлено, что реализация морфогенетического потенциала у редких и исчезающих видов растений определяется генетическими особенностями исходных растений, типом экспланта, его физиологическим состоянием, составом питательных сред и условиями культивирования.
Сформирована крупнейшая коллекция стерильных культур (72 генотипа) редких и исчезающих видов растений. В настоящее время создание таких коллекций является одним из перспективных направлений сохранения биоразнообразия растений.
Выводы
- Впервые создана крупнейшая коллекция редких и исчезающих растений в культуре in vitro, содержащая 72 вида, показана возможность использования методов биотехнологии для сохранения и воспроизведения редких видов растений.
- Разработана технология клонального микроразмножения на основе прямой регенерации растений путем активации пазушных меристем.
- Оптимальным режимом стерилизации на этапе введения в культуру является помещение семян и сегментов луковиц после спирта в 5-7%-ный раствор лизоформина на 10 минут, для растительных тканей 1-3%-ный раствор лизоформина с временной экспозицией 5-7 минут.
- Установлено, что оптимальной питательной средой на этапе микроразмножения является среда с добавлением БАП в концентрации 1,0-2,5 мг/л, на этапе укоренения - с добавлением ИУК и ИМК в концентрации 0,5-1,0 мг/л.
Рецензенты:
Ткаченко И.К., д.с.-х.н., профессор кафедры анатомии и физиологии живых организмов биолого-химического факультета Белгородского государственного университета Министерства образования и науки РФ, г. Белгород.
Кочкаров В.И., д.б.н., доцент, профессор кафедры фармацевтической химии и фармакогнозии фармацевтического факультета Белгородского государственного университета Министерства образования и науки РФ, г. Белгород.



