Целью настоящей работы явилось изучение развития возможных вариантов кровообращения и формирование центральной гемодинамики у детей с острыми лимфобластными лейкозами на разных этапах проводимой полихимиотерапии.
Материалы и методы.Обследовано 184 больных, из них 102 мальчика и 84 девочки, с острым лимфобластным лейкозом (ОЛЛ), находившихся на лечении в детском отделении клиники ГБОУ ВПО Ростовского государственного медицинского университета и в отделении онкологии и гематологии c химиотерапией ГБУ Ростовской области Областная детская больница. Средний возраст пациентов составил 6,74±0,49 лет. Медиана возраста больных составила 6,0 лет. В соответствии с рекомендациями по возрастной периодизации, предложенной Научно-исследовательским институтом физиологии детей и подростков АПН СССР (1965) было проведено разделение детей больных ОЛЛ на возрастно-половые подгруппы. Всем детям с ОЛЛ было проведено лечение по стандартной и промежуточной группам риска протокола ALL-MB-2008. Исследование показателей проводилось трехкратно, в связи с чем обследуемые были разделены на три группы. Первую группу составили 67 пациентов с острым лимфобластным лейкозом до начала полихимиотерапии, во вторую группу вошло 61 больных после проведения индукции ремиссии, третья группа была сформирована из 56 детей, интенсивный курс полихимиотерапии которым был завершен. Всем больным была выполнена комплексная трансторакальная ДэхоКГ с использованием сканера Aspen (Siemens-Acuson) с помощью кардиальных датчиков, имеющего программу для проведения тканевой допплерографии. Частота инсонации во время сканирования была от 2 до 4 МГц и зависела от глубины залегания и качества визуализации структур сердца. При проведении ДэхоКГ определялись все стандартные показатели. Основными параметрами, характеризующими состояние центральной гемодинамики, являются ударный объем (УО), минутный объем (МО), скорость сердечного выброса (ССВ) и общее периферическое сосудистое сопротивление (ОПСС). Так как диапазон получаемых у разных пациентов величин УО и МО достаточно широк, необходимо оценить эти параметры в зависимости от поверхности тела, поэтому определяли сердечный индекс. При этом эукинетический тип кровообращения был верифицирован, если показатели СИ определялись в рамках 25-75 центильного показателя, гиперкинетический - при СИ выше 75 центиля, а гипокинетический тип гемодинамики определялся при значении СИ ниже 25 центильной величины [8].
Результаты исследования и их обсуждение. Данные о типах кровообращения детей, находившихся на разных этапах полихимиотерапии, представлены в табл.1. При анализе данных, представленных в табл.1, следует, что у пациентов первой группы чаще формировались крайние варианты гемодинамики, при этом преобладал, регистрируясь более чем у половины детей, гиперкинетический тип кровообращения. В дальнейшем после проведения индукционного курса полихимиотерапии частота встречаемости гиперкинетического варианта кровообращения уменьшалась, и все типы гемодинамики регистрировались приблизительно одинаково. Однако при определении вариантов кровообращения у пациентов после окончания интенсивного курса полихимиотерапии вновь преобладали крайние варианты гемодинамики, при этом более чем у 50 % детей определялся гипокинетический тип гемодинамики. Следовательно, у детей первой группы преобладал гиперкинетический вариант кровообращения, а у пациентов после окончания полихимиотерапии (ПХТ) чаще формировался гипокинетический тип гемодинамики.
Таблица №1
Частота встречаемости вариантов кровообращения у детей с острым лимфобластным лейкозом на разных этапах полихимиотерапии
|
Тип гемодинамики |
Группа 1 N=67 |
Группа 2 N=61 |
Группа 3 N=56 |
|
Гиперкинетический |
35 (53,28%) |
17 (27,9%) |
21 (37,6%) |
|
Эукинетический |
10 (13,88%) |
21 (34,4%) |
5 (9,6%) |
|
Гипокинетический |
22 (32,83%) |
23 (37,7%) |
30(52,8%) |
Гипокинетический вариант кровообращения характеризовался увеличением артериовенозной разницы и коэффициента использования кислорода при снижении МО и повышении ОПСС, в то время как при гиперкинетическом типе гемодинамики увеличивался объем циркуляции крови, уменьшалась артериовенозная разница и коэффициент использования кислорода. Таким образом, механизмы, обеспечивающие капиллярно-тканевую диффузию кислорода у детей с ОЛЛ с разными типами кровообращения, по-видимому, неодинаковы. При этом центральная гемодинамика рано реагирует на нарушения работы сердца вследствие разных причин у пациентов с ОЛЛ. Преобладание гиперкинетического варианта кровообращения у детей в период разгара клинических проявлений ОЛЛ можно объяснить реакцией сердечно-сосудистой системы на гипоксию с целью адекватного обеспечения кислородной перфузии органов и тканей организма. При этом увеличение частоты встречаемости гипокинетического и эукинетического вариантов гемодинамики у пациентов в динамике полихимиотерапии может свидетельствовать о включении приспособительных механизмов в деятельность сердечно-сосудистой системы, так как гипокинетический тип является наиболее экономичным, и система кровообращения обладает большим адаптационным диапазоном. При этом способность изменять вариант кровообращения направлена на поддержание среднего АД, что обеспечивает адекватное кровоснабжение органов и тканей в связи с потребностями организма.
В табл. 2 представлено центильное распределение показателей центральной гемодинамики у детей с ОЛЛ на разных этапах ПХТ. При анализе данных, представленных в таблице, следует, что в основном у детей первой группы поддержание увеличенного сердечного выброса происходило за счет увеличения УО более чем у 70 % пациентов. В то время как у большинства пациентов 2 и 3 группы значения УО были ниже 25 центиля, а у 24 детей второй группы и 13 обследуемых третьей группы, что соответственно составляло 39,4 % и 23,2 %, УО регистрировался даже ниже 5 центиля. При этом увеличение МОК осуществлялось за счет преобладания положительных хронотропных и инотропных механизмов, в связи с чем увеличивались ЧСС и ССВ. А поддержание адекватных показателей артериального давления у пациентов происходило за счет повышения ОПСС. При этом уменьшение сердечного выброса может приводить к гипотонии. Рост периферического сопротивления создает преграду для увеличения сердечного выброса и уменьшает резерв сократительной способности миокарда, тем самым усугубляя сосудистую гипотонию. В то же время анализ данных, представленных в табл.3, свидетельствует о том, что у детей после окончания интенсивной ПХТ всех возрастных групп достоверно (p<0,05) уменьшалась ССВ, а ОПСС увеличивалось. Таким образом, механизмы формирования типов гемодинамики у пациентов с ОЛЛ при проведении ПХТ различны и являются приспособительной реакцией сердечно-сосудистой системы к меняющимся условиям функционирования.
Таблица № 2
Центильное распределение показателей центральной гемодинамики у детей с острым лимфобластным лейкозом
|
|
<5 |
5-25 |
25-75 |
75-95 |
>95 |
|||||
|
|
Абс. |
Отн. |
Абс. |
Отн. |
Абс. |
Отн. |
Абс. |
Отн. |
Абс. |
Отн. |
|
|
Ударный объем |
|||||||||
|
Группа 1 |
7 |
10,4% |
6 |
9,0% |
19 |
28,4% |
14 |
20,9% |
21 |
31,3% |
|
Группа 2 |
24 |
39,4% |
8 |
13,1% |
10 |
16,4% |
15 |
24,6% |
4 |
6,5% |
|
Группа 3 |
13 |
23,2% |
11 |
19,6% |
10 |
17,8% |
13 |
23,3% |
9 |
16,1% |
|
|
Минутный объем |
|||||||||
|
Группа 1 |
11 |
16,4% |
12 |
17,9% |
11 |
16,4% |
15 |
22,4% |
18 |
26,9% |
|
Группа 2 |
19 |
31,1% |
7 |
11,5% |
12 |
19,7% |
13 |
21,3% |
10 |
16,4% |
|
Группа 3 |
16 |
28,6% |
7 |
12,5% |
10 |
17,8% |
13 |
23,3% |
10 |
17,8% |
|
|
ССВ |
|||||||||
|
Группа 1 |
2 |
3,0% |
3 |
4,5% |
4 |
5,9% |
11 |
16,4% |
47 |
70,2% |
|
Группа 2 |
- |
- |
4 |
6,5% |
9 |
14,8% |
10 |
16,4% |
38 |
62,3% |
|
Группа 3 |
2 |
3,6% |
5 |
9,0% |
4 |
7,1% |
8 |
14,3% |
37 |
66,0% |
|
|
ЧСС |
|||||||||
|
Группа 1 |
3 |
4,5% |
14 |
20,9% |
16 |
23,9% |
25 |
37,3% |
9 |
13,4% |
|
Группа 2 |
1 |
1,6% |
14 |
22,9% |
12 |
19,7% |
24 |
39,4% |
10 |
16,4% |
|
Группа 3 |
5 |
9,0% |
16 |
28,6% |
13 |
23,2% |
18 |
32,1% |
4 |
7,1% |
|
|
АД систолическое |
|||||||||
|
Группа 1 |
4 |
5,9% |
11 |
16,4% |
43 |
64,3% |
8 |
11,9% |
1 |
1,5% |
|
Группа 2 |
5 |
8,2% |
13 |
21,3% |
31 |
50,9% |
10 |
16,4% |
2 |
3,2% |
|
Группа 3 |
3 |
5,4% |
11 |
19,6% |
33 |
58,9% |
5 |
9,0% |
4 |
7,1% |
|
|
АД диастолическое |
|||||||||
|
Группа 1 |
1 |
1,5% |
6 |
9,0% |
33 |
49,2% |
21 |
31,3% |
6 |
9,0% |
|
Группа 2 |
1 |
1,6% |
7 |
11,5% |
28 |
45,9% |
21 |
34,5% |
4 |
6,5% |
|
Группа 3 |
1 |
1,8% |
4 |
7,1% |
26 |
46,4% |
20 |
35,7% |
5 |
9,0% |
|
|
ОПСС |
|||||||||
|
Группа 1 |
19 |
28,4% |
11 |
16,4% |
23 |
34,4% |
4 |
5,9% |
10 |
14,9% |
|
Группа 2 |
17 |
27,9% |
12 |
19,7% |
12 |
19,7% |
6 |
9,8% |
5 |
9,0% |
|
Группа 3 |
15 |
26,8% |
10 |
17,8% |
11 |
19,6% |
14 |
22,9% |
15 |
26,8% |
Таблица № 3
Средние показатели параметров гемодинамики у детей с острым лимфобластным лейкозом
|
|
Группа 1 |
Группа 2 |
Третья группа |
|
|
2-3 года |
||
|
|
N=18 |
N=14 |
N=13 |
|
ЧСС |
105,17±5,03 |
97,28±3,85 |
96,85±2,88 |
|
УО |
24,79±1,2 |
21,71±1,38 |
24,49±1,64 |
|
МО |
2,63±0,21** |
2,11±0,15* |
2,36±0,16 |
|
ССВ |
175,05±14,1** |
141,11±9,51* |
157,59±10,45 |
|
ОПСС |
2327,99±157,66** |
2881,52±173,53* |
2596±220,47 |
|
САД |
87,5±1,4*** |
89,28±1,8 |
91,54±1,31* |
|
ДАД |
56,9±1,3 |
58,92±1,07 |
56,92±1,21 |
|
|
4-7 лет |
||
|
|
N=26 |
N=25 |
N=21 |
|
ЧСС |
100,3±5,03** |
102,32±2,37*** |
87,33±2,86*,** |
|
УО |
30,63±1,75 |
29,43±2,03 |
32,18±2,38 |
|
МО |
3,06±0,21 |
2,99±0,2 |
2,81±0,23 |
|
ССВ |
204,1±6,08*** |
199,34±13,52 |
187,27±5,23* |
|
ОПСС |
2186,59±166,73 |
2052,76±130,8*** |
2572,11±191,63** |
|
САД |
95,0±1,41 |
95,2±1,54 |
93,81±1,98 |
|
ДАД |
58,46±1,2 |
57,4±1,38 |
57,86±1,45 |
|
|
8-12(11х) лет |
||
|
|
N=15 |
N=15 |
N=14 |
|
ЧСС |
91,46±2,1 |
92,8±4,14 |
87,21±3,07 |
|
УО |
47,16±1,21*** |
48,69±3,56 |
52,91±2,14* |
|
МО |
4,32±0,12*** |
4,54±0,42 |
4,65±0,11* |
|
ССВ |
310,24±8,68*** |
303,19±28,24 |
288,09±6,05* |
|
ОПСС |
1483,0±85,37*** |
1534,75±164,1 |
1816,0±145,1* |
|
САД |
95,66±1,5*** |
98,66±3,39 |
100,36±1,65* |
|
ДАД |
63,66±1,24 |
61,33±1,33 |
62,86±1,25 |
|
|
13(12х)-16 (15х) |
||
|
|
N=8 |
N=7 |
N=8 |
|
ЧСС |
88,25±5,85 |
88,1±3,46 |
88,75±2,27 |
|
УО |
67,16±2,61**,*** |
60,37±1,95*,*** |
53,48±2,18*,** |
|
МО |
5,89±0,4*** |
5,31±0,26 |
4,74±0,4* |
|
ССВ |
392,76±19,27*** |
354,44±17,66 |
316,02±26,41* |
|
ОПСС |
1046,23±75,08*** |
1136,39±69,1*** |
1507±115,2*,** |
|
САД |
93,12±2,3*** |
94,28±2,29 |
103,13±4,29* |
|
ДАД |
60,62±1,9*** |
59,28±2,29*** |
68,13±3,22*,** |
Примечание: х - девочки ;* - данные являются достоверными по сравнению с 1 группой; ** - данные являются достоверными по сравнению с 2 группой; *** - данные являются достоверными по сравнению с 3 группой.
На рис.1 представлена частота встречаемости постоянных повышенных значений АД у пациентов с ОЛЛ в динамике ПХТ. Во всех группах обследуемых регистрировалось повышенное диастолическое АД (ДАД) более чем у 40 % детей. При развитии анемии уменьшается объем циркулирующей крови, что может приводить к нарушению периферической вазодилатации с дальнейшим увеличением ОПСС и, соответственно, ДАД. При этом повышенные показатели ДАД во всех группах обследуемых детей регистрировались приблизительно в одинаковом % случаев, в то время как частота встречаемости повышения систолического АД (САД) уменьшалась у пациентов третьей группы. Однако у всех обследуемых третьей группы с повышенным САД также регистрировалось и повышенное ДАД, на фоне увеличенного ОПСС и гипокинетического варианта гемодинамики. По-видимому, повышение АД у пациентов в период разгара клинических проявлений и после проведения индукционного курса ПХТ является приспособительным механизмом к функционированию сердечно-сосудистой системы в условиях гипоксии. В то время как сохраняющееся повышение АД у пациентов после окончания интенсивного курса ПХТ дает основание считать данное состояние срывом адаптационных механизмов и выделить данных пациентов в группу превентивного наблюдения с целью проведения мероприятий для предотвращения развития артериальной гипертонии.
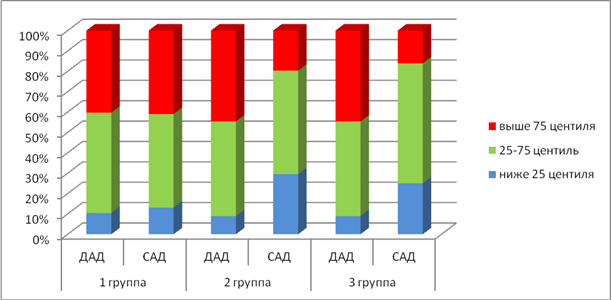
Рисунок 1. Частота встречаемости повышения АД у детей с ОЛЛ на разных этапах ПХТ.
Заключение. Таким образом, изменения центральной гемодинамики у пациентов с ОЛЛ в период проведения основного курса ПХТ носят адаптационный характер к постоянно изменяющимся условиям функционирования. У пациентов с ОЛЛ в период разгара клинических проявлений преобладает гиперкинетический вариант кровообращения, а у пациентов после окончания проведения основного курса ПХТ гипокинетический тип гемодинамики, что является приспособительной реакцией организма в зависимости от потребностей организма. При этом в дальнейшем всем пациентам с ОЛЛ необходимо проводить постоянный мониторинг показателей, отражающих состояние центрального кровообращения, и контроль АД для проведения профилактических мероприятий развития сердечно-сосудистых осложнений, в том числе артериальных гипер- и гипотоний.
Рецензенты:
Козель Ю. Ю., д.м.н., профессор, зав. отделением детской онкологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздравсоцразвития РФ, г. Ростов-на-Дону.
Лысенко И. Б., д.м.н., профессор, зав. отделением гематологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздравсоцразвития РФ, Ростов-на-Дону.



