Исследование диффузии молекул лекарственных веществ в липидной фазе на данный момент является одним из перспективных направлений в фармации, которое позволяет изучить механизм распределения препаратов в организме: преодоление клеточных мембран и дальнейший пассивный транспорт молекул [4, 5, 6, 7]. Степень растворимости в липидах по отношению к растворимости в воде характеризует липофильность и обычно определяется как коэффициент распределения октанол - вода (log P). Липофильность - физико-химический параметр, вызывающий большой интерес в QSAR (Quantitative Structure - Activity Relationships) исследованиях благодаря значительной роли в описании динамических и фармакокинетических аспектов действия биологически активных веществ. Экспериментально определение log P является достаточно трудоёмким и дорогостоящим, поэтому важно найти такой расчетный теоретический метод, который позволял бы с достаточно большей точностью предсказывать липофильность. Выбор оптимального метода для прогнозирования физико-химических свойств, к которым относится log P, является весьма актуальным в настоящее время [1, 2, 3].
Целью данной работы является изучение зависимости констант липофильности от квантово-химических параметров структурных фрагментов N-арилзамещенных производных антраниловой кислоты (16 соединений).
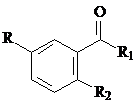
R= H, R1= NH2, R2= NH2 (I); R= H, R1= OH, R2= NHCH2C6H5 (II); R= H, R1= OH, R2= NHCOC6H4(2-OCH3) (III); R= H, R1= OH, R2= NH2 (IV); R= H, R1= OH, R2= NHCOCH2C6H5 (V); R= Br, R1= NH2, R2= NH2 (VI); R= Br, R1= NH2, R2= NHCOC6H5 (VII); R= Br, R1= NH2, R2= NHCOC6H4(4-NO2) (VIII); R= Br, R1= NH2, R2= NHCOC6H4(2-COOH) (IX); R= I, R1= NHCH2C6H5, R2= NHCOCH2C6H5 (X); R= I, R1= NHCH2CH2OH, R2= NHCOC6H5 (XI); R= I, R1= NHCH3, R2= NHCOC6H5 (XII); R= I, R1= NHNH2, R2= NHCOC6H5 (XIII); R= I, R1= NHCH3, R2= NHCO(2-фурил) (XIV); R= H, R1= OH, R2= NHCOC6H4(3-NO2) (XV); R= H, R1= OH, R2= NHCOC6H3(2,4-2Cl) (XVI).
Для изучения связи структуры с константами липофильности мы использовали из рассчитанных электронных параметров суммарные значения напряженности электрического поля Σ(Е), потенциала Σ(φ) и абсолютной величины заряда Σ(|q|) на атомах кислорода, азота, углерода и гидрофобного фрагмента Σ(Н). Структура гидрофобного фрагмента получена с помощью программы Ligand Scout 3,01. Указанный подход позволяет учесть структурные особенности исследуемого класса соединений и сводится к оценке влияния отдельных элементов структуры на липофильность. Квантово-химические параметры рассчитаны полуэмпирическими методами РМ3 и АМ1 с полной оптимизацией геометрии молекул с помощью программы Gaussian 03.
Экспериментально найденные величины констант липофильности соединений I - XVI приведены в таблице 1. Значения log Pэксп лежат в интервале от 1,38 до 3,42.
В исследуемых рядах соединений с использованием программы Microsoft Excel рассчитаны коэффициенты линейной корреляции Пирсона, отражающие зависимость log P экспериментального (log Pэксп) от квантово-химических параметров: ΣС(E), ΣО(E), ΣN(E), ΣC(φ), ΣО(φ), ΣN(φ), ΣC(|q|), ΣO(|q|), ΣN(|q|), ΣH(E), ΣH(φ) и ΣH(|q|). Для дальнейшего изучения связи констант липофильности с квантово-химическими характеристиками были отобраны суммарные параметры, дающие наибольшие коэффициенты корреляции (табл.1): ΣN(E), ΣО(φ), ΣO(|q|) и ΣH(E).
Таблица 1
Экспериментально определенные константы липофильности и квантово-химические параметры N-арилзамещенных производных антраниловой кислоты, рассчитанные методами РМ3 и АМ1
|
Соединение |
logPэксп |
Метод РМ3 |
Метод АМ1 |
||||||
|
ΣN(E) |
ΣО(φ) |
ΣO(|q|) |
ΣH(E) |
ΣN(E) |
ΣО(φ) |
ΣO(|q|) |
ΣH(E) |
||
|
I |
1,38 |
1,08 |
12,28 |
0,38 |
7,19 |
1,10 |
12,05 |
0,37 |
7,08 |
|
II |
2,46 |
0,24 |
13,45 |
0,38 |
16,24 |
0,29 |
13,24 |
0,37 |
15,79 |
|
III |
3,42 |
0,23 |
44,33 |
0,94 |
15,12 |
0,12 |
43,70 |
0,93 |
14,82 |
|
IV |
1,68 |
0,55 |
11,96 |
0,41 |
7,19 |
0,56 |
11,73 |
0,37 |
6,97 |
|
V |
1,99 |
0,10 |
28,92 |
0,70 |
16,67 |
0,11 |
28,15 |
0,63 |
16,49 |
|
VI |
1,59 |
1,09 |
12,36 |
0,40 |
6,81 |
1,10 |
12,16 |
0,40 |
6,68 |
|
VII |
2,09 |
0,84 |
28,59 |
0,71 |
15,86 |
0,63 |
27,96 |
0,69 |
15,44 |
|
VIII |
1,56 |
0,71 |
54,47 |
1,90 |
7,22 |
0,75 |
54,05 |
1,44 |
14,18 |
|
IX |
1,81 |
0,90 |
44,34 |
1,08 |
15,26 |
0,76 |
43,86 |
1,02 |
14,76 |
|
X |
2,85 |
1,00 |
33,68 |
0,71 |
25,87 |
0,70 |
32,82 |
0,74 |
25,85 |
|
XI |
2,78 |
0,75 |
45,13 |
0,97 |
16,48 |
0,48 |
44,57 |
1,01 |
15,77 |
|
XII |
2,68 |
0,70 |
29,68 |
0,71 |
15,93 |
0,55 |
29,31 |
0,74 |
15,49 |
|
XIII |
2,56 |
1,23 |
29,33 |
0,71 |
15,87 |
1,13 |
28,48 |
0,68 |
15,61 |
|
XIV |
2,74 |
0,62 |
28,34 |
0,73 |
12,51 |
0,57 |
27,79 |
0,69 |
12,33 |
|
XV |
1,51 |
0,53 |
54,52 |
1,96 |
15,91 |
0,70 |
53,76 |
1,40 |
13,60 |
|
XVI |
2,07 |
0,20 |
27,66 |
0,73 |
13,87 |
0,16 |
27,30 |
0,69 |
15,25 |
С целью установления корреляционной зависимости между константой липофильности и квантово-химическими параметрами был проведен множественный линейный регрессионный анализ, в ходе которого были использовано 4 переменных. Отбор переменных для уравнения регрессии проводили методом пошагового включения параметров, удовлетворяющих заданным уровням значимости статистических критериев. Помимо автоматической селекции, прибегали к принудительному включению параметров, обнаруживающих корреляционные связи с зависимой переменной log P. Всего было сгенерировано свыше 30 уравнений регрессии, из которых были отобраны по 2 уравнения для методов PM3 и AM1 с одинаковыми квантово-химическими параметрами (табл. 2).
Таблица 2
Уравнения регрессии связи констант липофильности (log P рассч) с квантово-химическими параметрами N-арилзамещенных производных антраниловой кислоты
|
№ |
Уравнение регрессии |
R |
F |
n |
|
Метод РМ3: |
||||
|
1 |
log P рассч1 = 1,520 + 0,060 × ΣО(φ) - - 1,892 × ΣO(|q|)+ 0,027 × ΣH(E) |
0,803 |
7,28 |
16 |
|
2 |
log P рассч2 = 2,000 - 0,296 × ΣN(E)+ + 0,074 × ΣО(φ) - 2,261 × ΣO(|q|) |
0,802 |
7,24 |
16 |
|
Метод АМ1: |
||||
|
3 |
log P рассч3 = 1,992 + 0,127 × ΣО(φ) - - 5,445 × ΣO(|q|) + 0,032 × ΣH(E) |
0,790 |
6,65 |
16 |
|
4 |
log P рассч4 = 2,488 - 0,204 × ΣN(E)+ + 0,143 × ΣО(φ) - 6,031 × ΣO(|q|) |
0,802 |
5,96 |
16 |
Полученные уравнения регрессии были использованы для расчёта значений log P восьми соединений.
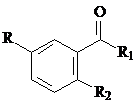
R= H, R1= NHCH2CH=CH2, R2= NHCO(2-фурил) (I); R= I, R1= NHCH2CH2OH, R2= NHCOCH2C6H5 (II); R= I, R1= NHCH2CH2OH, R2= NHCO(2-фурил) (III); R= I, R1= N(CH3)2, R2= NHCO(2-фурил) (IV); R= H, R1= NHC6H4(4-Br), R2= NHCH2C6H5 (V); R= H, R1= NHC6H4(4-Br), R2= N(COCH3)CH2C6H5 (VI); R= H, R1= NHC6H4(4-CH3), R2= NHCH2C6H5 (VII); R= H, R1= NHC6H4(4-CH3), R2= N(COCH3)CH2C6H5 (VIII).
Расчёты констант липофильности (log P рассч1, 2, 3, 4) выполняли с помощью четырёх уравнений. Полученные результаты с применением расчётных методов PM3 и AM1 приведены в таблице 3. Сопоставляя значения констант липофильности, представленные в таблице 3, можно отметить достаточно хорошую сходимость экспериментальных (log Pэксп) и расчётных величин (log P рассч1, 2, 3, 4).
Таблица 3
Экспериментальные и теоретически рассчитанные константы липофильности N-арилзамещенных производных антраниловой кислоты
|
Соединение |
PM3, log Pрассч |
АМ1, log Pрассч |
log Pэксп |
||
|
1 |
2 |
3 |
4 |
||
|
I |
2,35 |
2,35 |
2,42 |
2,34 |
2,35 |
|
II |
2,73 |
2,77 |
2,53 |
2,47 |
2,45 |
|
III |
2,52 |
2,68 |
2,14 |
2,20 |
2,60 |
|
IV |
2,27 |
2,38 |
2,10 |
2,12 |
2,90 |
|
V |
2,50 |
2,17 |
2,95 |
2,50 |
2,28 |
|
VI |
3,00 |
2,73 |
3,39 |
2,97 |
2,52 |
|
VII |
2,53 |
2,16 |
3,05 |
2,50 |
2,33 |
|
VIII |
3,05 |
2,73 |
3,42 |
2,93 |
2,40 |
Для проведения сравнительной оценки экспериментальных (log Pэксп) и расчётных величин (log P рассч1, 2, 3, 4) вычислены значения средней квадратичной ошибки прогноза для уравнений 1 - 4 : S1 = 0,30, S2 = 0,14, S3 = 0,91 и S4 = 0,33. Величина средней квадратичной ошибки свидетельствует о том, что использование уравнения №2 и квантово-химических параметров, рассчитанных методом PM3, приводит к более высоким результатам расчёта log P (S2 = 0,14), в сравнении с методом АМ1 (S3 = 0,91 и S4 = 0,33).
Таким образом, на основании результатов отбора расчётных квантово-химических дескрипторов получены корреляционные уравнения, которые адекватно описывают распределение веществ в двухфазной системе 1-октанол-вода и будут использованы в дальнейших исследованиях для прогнозирования log P вновь синтезированных соединений.
Рецензенты:
- Михалев А. И., д.фарм.н., профессор, зав. кафедрой биологической химии, ГБОУ ВПО ПГФА Минздравсоцразвития, г. Пермь.
- Панцуркин В. И., д.фарм.н., профессор, зав. кафедрой органической химии, ГБОУ ВПО ПГФА Минздравсоцразвития, г. Пермь.



