В условиях почечной недостаточности происходит ремоделирование сердца и сосудов, т.е. изменение их структуры и/или функции под воздействием ряда патологических факторов [1,9]. Экспериментальными и клиническими исследованиями установлено, что вне зависимости от гемодинамических условий уремия рассматривается как некоронарогенный фактор, определяющий большой спектр нарушений структуры миокарда у пациентов ХПН [6]. Прогностическое значение ремоделирования ЛЖ у больных ХПН было детально исследовано [8]. У больных с почечной недостаточностью гипертрофия левого желудочка (ГЛЖ) признается важным фактором неблагоприятного прогноза, что определено развитием нарушения коронарного кровообращения, систолической и диастолической дисфункций ЛЖ [2].
По данным крупных многоцентровых исследований (НЕМО Study 2000, HDFR 1989, Cardiovascular Health Study 1998) основной причиной смерти больных уремией являются болезни сердца и сосудов. В структуре смертности больных ТХПН кардиальная составляет от 40 до 54 % [4].
Цель исследования: выявление связи между «уремическими факторами» и процессами ремоделирования миокарда левого желудочка у больных на додиализной стадии ХБП.
Объекты и методы исследования. Для решения поставленных задач проведено клиническое и лабораторное обследование 120 человек, из них 90 пациентов с ХПН в различных стадиях, находившихся на лечении в отделении нефрологии УХМАО-Югры «Окружная клиническая больница» г. Ханты-Мансийск в 2006-2010 гг. Группу сравнения представили 30 здоровых добровольцев. Среди обследованных мужчин - 53, женщин - 67; средний возраст - 36,4 года+12,19. В группе сравнения средний возраст составил 25,6+6,23.
Критериями включения в исследование явились: наличие нефропатии с нарушением азотовыделительной функции почек (повышение уровня креатинина крови более 1,4 мг/дл (123 мкмоль/л) и/или снижение скорости клубочковой фильтрации ниже 90 мл/мин/1,73м2, сохраняющееся в течение года) у лиц старше 18 лет. Критериями исключения из исследования явились: возраст младше 18 и старше 55 лет; наличие сахарного диабета I или II типов; наличие сердечно-сосудистой патологии, развившейся до начала почечной патологии; реноваскулярная гипертензия, наличие тяжелых соматических и психических заболеваний (в том числе стенокардии напряжения III и IV ФК и ХСН III и IV ФК (NYHA)).
Структура нозологии в исследуемых группах: гломерулонефрит - 86 (71,7 %), ДЗСТ - 3 (2,5 %), ХТИН - 24 (20 %), АРМВС - 7 (5,8 %).
При обследовании у всех пациентов исследуемых и контрольной групп уровень гемоглобина (Нb) и гематокрит (Ht) определяли на гематологическом анализаторе «Beckman coulter». Уровень сывороточного железа (Fe) и общей железосвязывающей способности сыворотки (ОЖСС) - с расчетом сатурации трансферрина (Sat Fe); креатинина (Сrea), фосфора (Phos), кальция (Ca), С-реактивного белка (CRP) определяли на аппарате «Beckman coulter synchron Clinical system CX4». Обследование проведено в стадии ремиссии основного заболевания. Сатурация трансферрина (St.tr) определялась по формуле: Fe/ОЖСС х 100 %. Ферритин определяли на аппарате Beckman coulter Access Immunoassay system. Маркерами дефицита железа считались: содержание ферритина сыворотки < 200 мкг/л у больных на гемодиализе и < 100 мкг/л у больных на перитонеальном диализе и с додиализной ХПН; насыщение трансферрина < 20 %;
Уровни иПТГ и гомоцистеина определялись методом иммуноферментного анализа (ИФА).
Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле Cockroft-Gault: СКФ=[(140-возраст-вес (кг) -0,85 (для женщин)]/[72-креатинин сыворотки (мг/дл)], мл/мин. В соответствии с рекомендациями Национального почечного фонда США (NKF K/DOQI, 2002 г.) по уровню СКФ устанавливалась стадия хронической болезни почек (ХБП).
АГ диагностировалась согласно российским рекомендациям по артериальной гипертензии (ВНОК, 2011), гипертрофия левого желудочка (ГЛЖ) диагностировалась при ИММЛЖ более 125 г/м² у мужчин и более 110 г/м² у женщин.
По данным эхокардиографии (в М- и В-режимах) и допплеро-эхокардиографии определялись линейные размеры сердца, фракция выброса (ФВ), диастолическая функция левого желудочка (ЛЖ). По формуле L. Teichgolz рассчитывались объемы ЛЖ в систолу (КСО), диастолу (КДО), конечный диастолический размер ЛЖ (КДР), ударный объем (УО), толщину задней стенки ЛЖ (ТЗС), толщину межжелудочковой перегородки (ТМЖП). Масса миокарда левого желудочка (ММЛЖ) рассчитывалась по формуле Devereux R. B. (1977). Индекс ММЛЖ (ИММЛЖ) получали как отношение ММЛЖ к площади поверхности тела (ММЛЖ/ППТ). Относительная толщина стенок (ОТС) левого желудочка рассчитывалась по формуле ОТС = (ТЗС+ТМЖП)/КДР. Диастолическая функция левого желудочка оценивалась с помощью допплер-эхокардиографии: определялись максимальные скорости раннего (Е) и позднего (А) диастолического наполнения, их отношение (Е/А), время изоволюмического расслабления левого желудочка (IVRT), время замедления раннего диастолического наполнения (DT).
Первоначально результаты обработаны с использованием методов непараметрической статистики с помощью пакетов статистических программ SPSS 16.0 for Windows. Проводился корреляционный анализ с расчетом коэффициента ранговой корреляции по Спирмену (R). Различия считали достоверным при р<0,05.
Анализ данных исследования по методу канонических корреляций выполнялся на кафедре высшей математики Югорского государственного университета. Для проведения анализа использовался модуль «Canonical Analysis» в статистической программе Statistica, release 6 (StatSoft, USA).
Результаты и обсуждение. СКФ в исследуемой группе составила 54,02+43,3 мл/мин. В данном исследовании в группе додиализной ХБП гипертрофия миокарда левого желудочка выявлена у 56 человек (62,2 %). При проведении парного корреляционного анализа с помощью пакетов статистических программ SPSS 16.0 for Windows не получено высокой корреляционной связи между «уремическими» факторами риска сердечно-сосудистых осложнений и ИММЛЖ. При этом взаимосвязь с уровнем креатинина оказалась слабой - R 0,321; р<0,002. Более значимой оказалась корреляция ИММЛЖ с уровнем СКФ (R -0,413; р<0,0001), фосфора (R 0,405; р <0,0001), РхСа (R 0,402; р<0,0001), ферритина (R 0,426; р<0,0001).
Диастолическая дисфункция ЛЖ в описываемой группе встречается у 52 человек, при этом 1 тип - у 36 человек (30 %); 2 тип - «рестриктивный» - у 16 человек (13,3 %). Отношение скоростей раннего диастолического наполнения и наполнения в систолу предсердий (E/А) было снижено у 51 (40 %) пациента и составляло в среднем 1,298+0,57 (таб. 1). Время изоволюмического расслабления левого желудочка (IVRT) превышало норму у 48 (53,3 %) человек, в среднем - 92,02+22,24 мс. Время замедления раннего диастолического наполнения (DT) было выше нормы у 47 (52,2 %), в среднем - 202,74+38,22 мс. (таб.1). У 16 пациентов наблюдалась «псевдонормализация» показателя Е/А, со снижением IVRT и DT (второй тип патологического трансмитрального потока), ассоциированная с более тяжелым нарушением функциональной способности миокарда ЛЖ. Не выявлено корреляции показателей диастолической функции левого желудочка и уровнем СКФ. Обнаружена слабая (но достоверная) связь между показателями фосфорно-кальциевого обмена и скоростью в пике Е (РхСа r 0,241; иПТГ r 0,237, р<0,005), нет подобной корреляции со скоростью в пике А. В отличие от литературных данных не выявлено положительной корреляции с уровнем Нв. Возможно, у пациентов с ХПН анемия влияет на структуру трансмитрального кровотока, приводя к увеличению скорости наполнения левого желудочка в раннюю диастолу, что может приводить к «псевдонормализации» показателя Е/А. Вторичный гиперпаратиреоз влияет на показатели диастолической функции левого желудочка, что, вероятно, связано с участием паратиреоидного гормона в генезе интерстициального фиброза миокарда в условиях уремии. В экспериментальных исследованиях было доказано, что ведущая роль в поражении интрамиокардиальных артерий принадлежит паратгормону [7].
Таблица 1
Результаты описательной статистики структурно-функциональных показателей миокарда у больных ХБП
|
Параметры |
M |
SD |
Параметры |
M |
SD |
|
LOG GFR |
3,50 |
1,15 |
КДР |
4,58 |
0,72 |
|
САД |
157,13 |
34,11 |
Е |
0,84 |
0,19 |
|
ДАД |
94,96 |
16,83 |
А |
0,67 |
0,18 |
|
ЧСС |
75,57 |
8,17 |
IVRT |
92,02 |
22,24 |
|
КДО |
93,43 |
17,60 |
DT |
202,74 |
38,22 |
|
МЖП |
11,31 |
1,78 |
ММЛЖ |
225,33 |
87,54 |
|
ЗСЛЖ |
11,11 |
1,68 |
ОТСЛЖ |
0,50 |
0,11 |
|
ФВ |
62,32 |
5,16 |
|
|
|
Примечание. Здесь и в таб. 2: SD - стандартное отклонение от среднего значения.
Все вышеизложенное послужило поводом для попытки оценки влияния совокупности «уремических» показателей на множество структурно-функциональных показателей миокарда ЛЖ. Для исследования такого комплексного влияния использовался статистический метод канонических корреляций, позволяющий суммировать вклады отдельных факторов в общую картину ремоделирования миокарда ЛЖ в условиях ХБП.
Этап предварительного анализа предполагал исследование распределений исследуемых переменных, для чего были рассчитаны описательные статистики параметров сравниваемых множеств с определением среднего и стандартного отклонения (таб. 1, 2). Некоторые показатели обладали выраженным асимметричным распределением, поэтому они были прологарифмированы (Log GFR, Log PTH, Log Crea, Log Ferritin). В этом виде они имели нормальное распределение.
Таблица 2 Результаты описательной статистики уремических факторов риска ССЗ у больных ХБП
|
Параметры |
M |
SD |
Параметры |
M |
SD |
|
возраст |
36,44 |
12,19 |
Hb |
115,79 |
27,23 |
|
пол |
0,55 |
0,50 |
Ht |
33,38 |
7,94 |
|
BSA |
1,82 |
0,22 |
Fe |
14,37 |
7,67 |
|
LOG Crea |
-1,34 |
1,02 |
ОЖСС |
51,08 |
13,15 |
|
Phos |
1,57 |
0,72 |
SatTr |
28,88 |
15,39 |
|
Ca |
2,20 |
0,20 |
LOG Ferritin |
4,48 |
1,11 |
|
PxCa |
3,40 |
1,45 |
СRP |
0,60 |
0,51 |
|
LOG PTH |
4,26 |
1,34 |
Гомоцистеин |
12,05 |
10,66 |
|
Alb |
34,80 |
7,08 |
|
|
|
Нормальность распределения морфо-функциональных показателей и лабораторных параметров позволила проанализировать парные корреляции по Пирсону (R) (таблица 3). При обработке данных достоверная корреляция (р <0,05) получена в первых трех канонических корнях: с каноническим R, соответственно, 0,89; 0,73; 0,65.
Таблица 3 Уровень канонических корреляций
|
№ |
Canonicl R |
Canonicl R-sqr. |
Chi-sqr. |
df |
p |
Lambda Prime |
|
0 |
0,89 |
0,79 |
468,57 |
252 |
0,0000 |
0,0103 |
|
1 |
0,73 |
0,54 |
309,14 |
221 |
0,0001 |
0,0490 |
|
2 |
0,65 |
0,42 |
230,30 |
192 |
0,0307 |
0,1057 |
Значения достоверных коэффициентов корреляций по Пирсону были больше 0,5 и меньше 0,9, т.е. имели среднюю или сильную силу связи между параметрами уремии и суммарным фактором левого множества данных. Обращает внимание сильная связь составляющих фосфорно-кальциевого обмена (LOG PTH 0,826; Phos 0,682; PxCa 0,644); анемического синдрома (Hb -0,739; Нt -0,752). Столь же высокими оказались коэффициенты корреляции для гомоцистеина (0,780) и СRP (0,817). Наиболее значимой была корреляция, выявленная при анализе факторных нагрузок левого множества («уремические» факторы) первого канонического корня.
Из факторных нагрузок параметров правого множества - ось Y (рис.2) наибольшее значение имели показатели САД (R 0,905), ДАД (R 0,884), МЖП (R 0,713), ММЛЖ (R 0,520), скорость в пике А (R 0,498). Нарастание влияния скорости в пике Е выявлено при анализе данных факторных нагрузок третьего канонического корня (R 0,636).
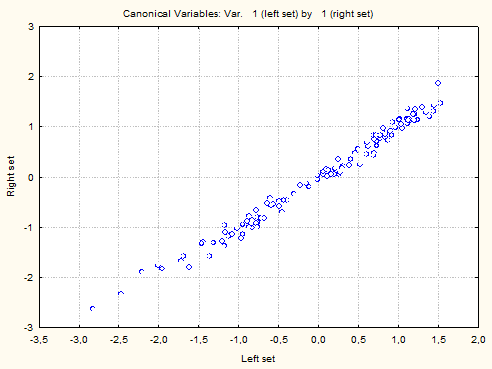
Рис. 2. Факторные нагрузки 1-го канонического корня и диаграмма первой канонической корреляции (уремические факторы - ось абсцисс, структурно-функциональные показатели ЛЖ - ось ординат)
Выявлены статистически достоверные позитивные и негативные корреляции между величинами «уремических» факторов и показателями гипертрофии миокарда и диастолической функции ЛЖ. При проведении регрессионного анализа получили канонические (весовые) коэффициенты обоих множеств. В таблице 4 показаны результаты применения метода канонической корреляции для определения влияния факторов уремии на структурные и функциональные параметры миокарда ЛЖ с расчетом весовых коэффициентов.
Таблица 4 Канонические (весовые) коэффициенты левого множества
|
N |
Var |
Root 1 |
Root 2 |
Root 3 |
N |
Var |
Root 1 |
Root 2 |
Root 3 |
|
1 |
возраст |
0,026 |
-0,038 |
-0,080 |
10 |
Ht |
-0,010 |
-0,327 |
0,105 |
|
2 |
пол |
0,086 |
0,269 |
-0,008 |
11 |
Fe |
-0,236 |
0,063 |
0,227 |
|
3 |
BSA |
0,118 |
-0,009 |
0,095 |
12 |
ОЖСС |
0,165 |
0,059 |
-0,118 |
|
4 |
LOG Crea |
0,609 |
-0,044 |
-0,263 |
13 |
SatTr |
0,183 |
0,032 |
-0,208 |
|
5 |
Phos |
-0,500 |
-0,580 |
-0,532 |
14 |
LOG Ferritin |
-0,177 |
-0,024 |
0,014 |
|
6 |
Ca |
-0,169 |
-0,182 |
-0,038 |
15 |
СRP |
0,154 |
-0,145 |
-0,047 |
|
7 |
PxCa |
0,353 |
0,569 |
0,674 |
16 |
Гомоцистеин |
0,086 |
0,063 |
0,065 |
|
8 |
LOG PTH |
0,006 |
-0,077 |
0,082 |
17 |
Alb |
-0,117 |
-0,043 |
0,062 |
|
9 |
Hb |
0,090 |
0,254 |
-0,133 |
18 |
LOG GFR |
0,049 |
-0,130 |
-0,149 |
Суммируя данные, можно утверждать, что корреляционная (каноническая) связь между параметрами ЛЖ и комбинацией «уремических» факторов достигает R=+0,83; р=0,000. Показано наличие сильной (Canonical R>0,7) положительной связи между процессами ремоделирования миокарда и показателями уремии. Эта максимальная связь наблюдается при весовых коэффициентах, равных (по мере убывания): 0,609 для LOG Crea; -0,500 для Р; 0,353 для РхСа (с нарастанием в третьем каноническом корне до 0,663); и всего лишь 0,090 для Нв; 0,009 для ПТГ. Таким образом, максимальный эффект на структурно-функциональные параметры оказывают показатели фосфорно-кальциевого обмена. Весовые коэффициенты переменных отражают реальный относительный вклад каждого фактора в конечную каноническую корреляцию между результативными переменными и анализируемыми факторами.
Выводы
- Между уремическими факторами риска развития сердечно-сосудистых осложнений и структурно-функциональными изменениями сердца существуют нелинейные зависимости. Результаты канонического корреляционного анализа позволили ранжировать «уремические» факторы риска в процессе ремоделирования миокарда ЛЖ с наибольшим весом для LOG Crea и показателей фосфорно-кальциевого обмена.
- Метод канонических корреляций позволяет суммировать вклады отдельных факторов уремии в процессы ремоделирования миокарда и дает возможность выявлять скрытую зависимость нескольких результирующих факторов и большого числа определяющих факторов.
Рецензенты:
- Попова М. А., доктор медицинских наук, профессор, зав. кафедрой госпитальной терапии ГОУ ВПО «Сургутский государствнный университет ХМАО-Югры», г. Сургут.
- Хадарцев А. А., доктор медицинских наук, профессор, директор медицинского института Тульского государственного университета, заведующий кафедрой «Внутренние болезни», г.Тула.



