При этом помимо ишемического прекондиционирования существует фармакологическое, которое с клинической точки зрения выглядит предпочтительнее, так как технологически проще и лишено потенциальной опасности ишемических эпизодов для измененного миокарда. В связи с феноменом фармакологической тренировки упоминается хорошо известный миокардиальный цитопротектор - милдронат (3-(2,2,2-триметилгидразиний) пропионат), являющийся ведущим представителем вышеупомянутого класса [8,10]. При блокировании эндотелиальной, индуцибельной NO-синтазы, АТФ-зависимых калиевых каналов противоишемические эффекты милдроната нивелируются [3].
Препарат эффективен в лечении ишемических состояний: он вызывает в клетках эффект прекондиционирования, оказывая выраженный защитный эффект при ишемическом и реперфузионном повреждении миокарда, способствуя повышению эффективности утилизации кислорода миокардиальной тканью [4]. Его антиоксидантный эффект позволяет уменьшить образование в крови и тканях активных форм кислорода и перекисных радикалов, предотвращая повреждение клеточных структур [1]. Выявлено, что милдронат, сам не обладающий свойствами антиоксиданта, повышает в организме концентрацию ГББ, так как под влиянием милдроната он медленнее окисляется до карнитина. В свою очередь, ГББ способен индуцировать образование NO, который является одним из триггеров ишемического прекондиционирования и действует как один из эффективных природных агентов, связывающих свободные радикалы в организме, что обусловливает такие эффекты Милдронат®, как снижение периферического сопротивления сосудов, уменьшение вызванных норадреналином или ангиотензином спазмов кровеносных сосудов, торможение агрегации тромбоцитов и увеличение эластичности мембран эритроцитов.
Общеизвестно, что введение в молекулу лекарственного вещества дополнительных функциональных групп приводит к расширению спектра его фармакологической активности. При этом важно, чтобы дополнительные свойства не приводили к снижению эффективности препарата, а наоборот способствовали усилению его основного эффекта.
В связи с этим целью нашего исследования явилось изучение антиоксидантной и противоишемической активности 3-(2,2,2-триметилгидразиния) пропионата Милдронат® (пр-ва АО «Гриндекс») и его производных (никотинат, 5-бромникотинат, 5-гидроксиникотинат, глицинат ) 3-(2,2,2-триметилгидразиний) пропионат, синтезированных в ВНЦ БАВ, при моделировании коронароокклюзионного инфаркта миокарда.
Материалы и методы. Исследовано 4 химических производных 3-(2,2,2-триметилгидразиний) пропионата (никотинат, 5-бромникотинат, 5-гидроксиникотинат, глицинат) (3-(2,2,2-триметилгидразиний) пропионат) и препарат сравнения Милдронат®.
Для определения антиоксидантной активности (АОА) Милдроната® и его производных отбирались навески этих образцов в количестве 0,05 г, 0,049 г, 0,051 г, 0,05 г и 0,053 г соответственно. Навески переносили в мерные колбы на 25 мл и доводили до метки водой. Для обеспечения лучшего растворения и гомогенизации препаратов использовали ультразвуковую баню УЗВ 1/100-TH-РЭЛТЕК. Полученные экстракты исследовали на суммарную антиоксидантную активность.
Измерение АОА производили на приборе Цвет Яуза 01-АА с вольт-амперометрическим детектором при постоянстве напряжения 1,3 В в постоянно-токовом режиме (АД п.т.). В качестве элюента использовали раствор ортофосфорной кислоты с молярной концентрацией 0,0022 моль/л. Скорость подачи элюента 1,2 см3/мин. Обработку данных проводили при помощи ПО «АДКД». Амперометрический метод измерения суммарной массовой концентрации антиоксидантов основан на изменении силы тока, в ячейке, возникающей на поверхности электрода в результате реакций окисления молекул антиоксиданта при определенном потенциале, который после усиления преобразуется в цифровой сигнал.
Изучение выживаемости ишемизированного миокарда было проведено на 36-и лабораторных кроликах массой 2-2,5 кг. Исследуемые соединения: 3-(2,2,2-триметилгидразиния) пропионата Милдронат® и его производные (никотинат, 5-бромникотинат, 5-гидроксиникотинат, глицинат) (3-(2,2,2-триметилгидразиний) пропионат), в дозе, с учетом молярной массы 3-(2,2,2-триметилгидразиния) пропионата, исходя из количества вещества 0,274 моль/кг, что составило 40 мг/кг для 3-(2,2,2-триметилгидразиний) пропионата, а дозы производных соответственно СТК 733 - 84,1 мг/кг, СТК 734 - 105,5 мг/кг, СТК 735 - 88,5 мг/кг, СТК 61К - 71,0 мг/кг, предварительно растворяли в стерильном физиологическом растворе и вводили наркотизированным (хлоралгидратат 300 мг/кг) животным в маргинальную вену уха кролика, находящегося на управляемом дыхании, за 30 минут до перевязки левой нисходящей коронарной артерии. После 30 минут коронарной окклюзии осуществляли снятие лигатуры и осуществляли реперфузию миокарда в течение 90 мин. После чего проводили забор крови из правого желудочка в одноразовую вакуумную пробирку с антикоагулянтом, для определения специфического маркера сердечной мышцы Troponin I (TnI). Уровень тропонина определяли на иммунофлуоресцентном приборе Triage MeterPro (Biosite, США). Размеры зоны некроза миокарда определяли через 2 ч. Поперечные срезы миокарда производили через каждые 0,8 см, начиная с уровня 0,8 см ниже места наложенной лигатуры. Срезы миокарда помещали в емкость, содержащую фосфатный буфер (рН 7,4) и 1 мг/мл трифенилтетразолия хлорид. Соотношение масс участков ткани и буфера составляло 1:9. Бюксы помещали в термостат и инкубировали при 37 С 0 в течение 15 минут до образования красного формазана. Подсчет площадей интактного и некротизированного миокарда левого желудочка производили на каждом из четырех срезов с помощью попиксельного анализа в программе Adobe Photoshop 9.0.
Результаты исследования и их обсуждение
Результаты исследования антиоксидантной активности
Препарат МилдронатR и все его производные, кроме 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат, не обладают АОА in vitro.
Антиоксидантная активность 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионата наиболее ярко выраженная. В пересчете на аскорбиновую кислоту составляет 9,2 мг (А.К.)/л. В качестве стандартного вещества для построения калибровочного графика была использована аскорбиновая кислота исходной концентрации 1г/л. По полученным данным строили график зависимости выходного сигнала (площадь пика) от концентрации, рисунок 1.1.
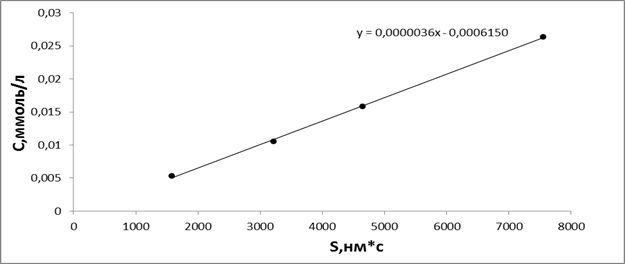
Рисунок 1.1. Калибровочный график зависимости выходного сигнала от концентрации аскорбиновой кислоты
Далее по этому графику определяли массовую концентрацию антиоксиданта.
В результате окисления производного 3-(2,2,2-триметилгидразиния) пропионата - 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат калия - на поверхности электрода происходит усиление электрического тока. Возникающие электрические токи очень малы, в пределах 10-6-10-9А.
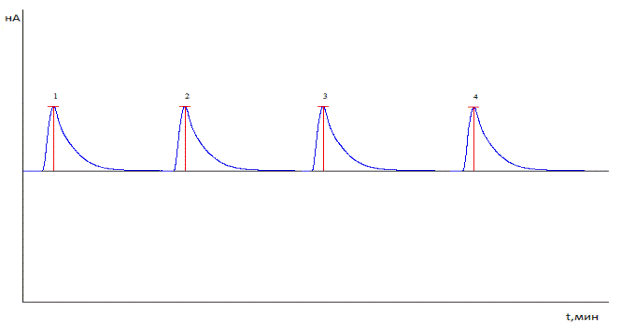
Рисунок 1.2. Сигналы, зарегистрированные при четырех последовательных введения раствора 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат (199 мг/ кг) на приборе Цвет Яуза-01-АА
Эти аналоговые сигналы усиливаются, а затем с помощью аналого-цифрового преобразователя преобразуются в цифровой сигнал, который регистрируется на дисплее компьютера рисунок 1.2. Среднее квадратичное отклонения составляет менее 1 %.
Результаты исследования противоишемического действия
Наложение лигатуры на нисходящую ветвь левой коронарной артерии у кроликов в контрольной группе животных приводило к развитию некроза миокарда, размер которого составил 27,3±1,2 % от общей площади миокарда. Соответственно, размер интактного миокарда составлял 72,7±1,2 %. Введение перед моделированием коронарооклюзии эталонного препарата Милдроната® в дозе 90 мг/кг приводило к уменьшению площади некротизированного миокарда до 20,2±1,0 %. Наибольшая протективная активность обнаружена у соединения 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат (88,5мг/ кг), введение которого привело к достоверному уменьшению площади некротизированного миокарда в 2 раза до 13,1±1,4 %. Все остальные производные также привели к достоверному снижению размера зоны некроза, но в меньшей степени (таблица 1).
Являясь специфическим маркером инфаркта миокарда тропонина I (TnI), обнаруживается в сыворотке крови спустя несколько минут после инфаркта миокарда и коррелирует с его размером. При определении коцентрации TnI в нашем эксперименте, наименьшая концентрация обнаружена у соединения 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат - 6,04±1,6 нг/мл. У всех остальных она сопоставима с размером инфаркта данной группы (таблица 1).
Определение зоны некроза миокарда является информативным показателем в определении противоишемического действия препарата.
Влияние Милдроната® и его производных на величину зоны некроза и концентрацию Troponin I при моделирования коронаро-окклюзионного инфаркта миокарда (М±m,n=6)
Таблица 1
|
Группа |
% некроза |
% интактного миокарда |
уровень тропонина I (нг/мл) |
|
Контроль (инфаркта миокарда ) |
27,3±1,2 |
72,7±1,2 |
16,26±1,9 |
|
ИМ+ милдронат (40 мг/ кг) |
20,2±1,0* |
79,8 ± 0,5 |
12,2±1,1* |
|
ИМ + Никотинат 3-(2,2,2-триметилгидразиний) пропионат (84,1 мг/ кг) |
17,9±1,3* |
82,1±0,7 |
10,95±1,8* |
|
ИМ+ 5-бромникотинат 3-(2,2,2-триметилгидразиний) пропионат (105,5 мг/кг) |
16,0±0,8* |
84,0±1,2 |
7,7±1,5* |
|
ИМ+ 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат (88,5 мг/ кг) |
13,1±1,4* |
86,9±1,3 |
6,04±1,6* |
|
ИМ + глицинат 3-(2,2,2-триметилгидразиний) пропионат (71,0 мг/ кг) |
17,2±1,4* |
82,8±1,1 |
10,15±1,1* |
Примечание: * - р≤0,05 при сравнении с контрольной группой.
Установлено, что профилактическое введение соединений производных 3-(2,2,2-триметилгидразиний) пропионата (никотинат, 5-бромникотинат, 5-гидроксиникотина, глицинат) (3-(2,2,2-триметилгидразиний) пропионат) в соответствующих дозах приводит к уменьшению зоны некроза. Результаты экспериментов с введением исследуемых соединений указывают на их выраженную противоишемическую активность, большую, чем у препарата сравнения Милдроната®.
По мере развития ишемии миокарда за несколько минут повышается содержание в плазме норэпинефрина, при этом активируется липолиз жировой ткани, что ведет к повышению свободных жирных кислот в крови. Кроме того, катехоламины также приводят к снижению продукции инсулина бета-клетками поджелудочной железы, что нарушает транспорт глюкозы в клетки миокарда.
Фармакологические препараты, ингибирующие липолиз и высвобождение свободных жирных кислот, их транспорт и окисление, а также активирующие окисление глюкозы и ее транспорт в клетки миокарда, можно рассматривать как многообещающие терапевтические средства для оптимизации продукции АТФ в условиях снижении концентрации доступного кислорода [9].
Бета-блокаторы представляют собой группу давно используемых фармакологических препаратов, обладающих свойством ингибирования липолиза и высвобождения свободных жирных кислот [7].
Другим хорошо известным препаратом является никотиновая кислота, однако сама по себе она не может применяться при острых ишемических синдромах, поскольку, будучи сосудорасширяющим средством, снижает кровяное давление и повышает эффективность функционирования миокарда. Профессор М. Оливер показал, что 5-фторзамещенное никотиновой кислоты снижает содержание свободных жирных кислот в плазме уже через 30 минут после приема. Это производное является эффективным средством для снижения частоты желудочковой аритмии при остром инфаркте миокарда.
Таким образом, разработка избирательных и активных нетоксичных ингибиторов липолиза является перспективным направлением в создании новых противоишемичиских препаратов.
С другой стороны, нужно воздействовать и на другие биохимические этапы окисления свободных жирных кислот. И основная задача биохимического вмешательства в метаболические процессы состоит в переключении с анаэробного использования глюкозы с образованием лактана на аэробное окисление, поскольку последнее представляет собой наиболее экономичный в плане расходования кислорода путь образования АТФ. Милдронат индуцирует экспрессию саркоплазматических ферментов Са-АТФазы, Nа, К-АТФазы и способствует переключению метаболизма со свободных жирных кислот как субстратов на окисление глюкозы. Он также приводит к фармакологической тренировке миокарда, адаптируя клетки к ишемии, т. е имеет место эффект прекондиционирования, который уменьшает риск развития инфаркта в условиях ишемизации миокарда.
Введение в молекулу 3-(2,2,2-триметилгидразиний) пропионата новой функциональной группы предполагает выявление новых свойств и усиление противоишемического эффекта, однако закономерно, что в зависимости от вводимой компоненты диапазон активности полученных субстанций может варьировать. Введение группы 5-гидроксиникотината в молекулу 3-(2,2,2-триметилгидразиний) пропионата приводит к усилению антиоксидантной активности исследуемой субстанции и повышению противоишемической активности по сравнению с другими субстанциями.
Несмотря на многочисленные эксперименты и клинические исследования, фармакотерапия ишемической болезни сердца нуждается в изыскании и внедрении в практику новых препаратов [2,5].
Данные, полученные в наших экспериментах, подтверждают перспективность дальнейшего углубленного изучения производных 3-(2,2,2-триметилгидразиний) пропионата (никотинат, 5-бромникотинат, 5-гидроксиникотинат, глицинат) (3-(2,2,2-триметилгидразиний) пропионат) как потенциальных кардиофармакологических препаратов.
Выводы:
- 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат проявляет умеренную антиоксидантную активность при амперометрическом методе исследования на приборе Цвет Яуза 01-АА.
- Производные 3-(2,2,2-триметилгидразиния) пропионата (никотинат, 5-бромникотинат, 5-гидроксиникотинат, глицинат) (3-(2,2,2-триметилгидразиний) пропионат калия) - обладают противоишемическим эффектом на модели коронаро-окклюзионного инфаркта миокарда, наиболее ярко выраженным, чем у препарата сравнения милдроната. Данный показатель варьирует в зависимости от введенной в структуру молекулы функциональной группы, максимально проявляясь у 5-гидроксиникотинат 3-(2,2,2-триметилгидразиний) пропионат в дозе 88,5 мг/кг.
Рецензенты:
- Будко Е. В., д.фарм.н., профессор кафедры фармацевтической, токсикологической и аналитической химии Курского государственного медицинского университета, г. Курск.
- Панкрушева Т. А., д.фарм.н., профессор, зав. кафедрой фармацевтической технологии ГБОУ ВПО «Курский государственный медицинский университет», г. Курск.



