При содержании в воде солей кальция и магния, обуславливающих жесткость выше норматива (7 0Ж) [10], требуется умягчение. Оно может быть осуществлено методом ионного обмена, мембранными технологиями, с применением осмоса. Все эти методы являются трудоемкими и ресурсо-затратными, на практике чаще применяют ионный обмен и реагентное умягчение, причем главным образом – при подготовке воды для производственного использования. Поэтому для удаления солей временной жесткости из водных растворов был предложен метод с использованием жидкого катализатора.
Эффективное решение проблемы устранения солей жесткости при применении жидкого катализатора возможно лишь на базе тщательного изучения физико-химических основ данного процесса.
Метод физико-химических расчетов – это метод исследования природных и экспериментальных физико-химических процессов путем приложения аппарата расчетных методов физической химии и термодинамики. Расчеты химических равновесий являются важнейшим этапом рассмотрения любых массообменных процессов, осложненных химической реакцией. На основе физико-химических параметров простых веществ и соединений, а именно на основе зависимости теплоемкости от температуры, давления и т.д., т. е энтальпийным методом, можно произвести расчет энергии Гиббса с последующим определением константы равновесия различных химических превращений. Знание этих величин позволяет определить направления реакций, их тепловой эффект, рассчитать состав равновесной системы, а также установить взаимосвязь изменения всех этих характеристик от внешних параметров, то есть подобрать оптимальные условия проведения процесса.
В данной работе рассмотрен процесс удаления солей временной жесткости, а именно гидрокарбоната кальция, с применением жидкого катализатора. При введении в водные растворы жидкого катализатора растворимый гидрокарбонат кальция переходит в нерастворимый углекислый кальций.
Для умягчения воды используют такие реагенты, как Са(ОН)2, Na(ОН), Na2CO3. В данной работе предложено применение водного раствора аммиака в качестве жидкого катализатора. Как известно, реакционная способность системы зависит от ионной подвижности.
Таблица 1. Ионные электропроводимости (подвижности ионов) λ+ и λ- в разбавленных водных растворах при 25 0С [в см2/(Ом/г-экв)] [9].
|
Катион |
λ + |
Анион |
λ+ |
|
Н+ |
349,82 |
ОН- |
197,6 |
|
К+ |
73,55 |
Сl- |
76,34 |
|
NH4+ |
73,7 |
NO3- |
71,44 |
|
Ag+ |
61,92 |
ClO4- |
67.31 |
|
Na+ |
50,11 |
HCO3- |
44,48 |
|
1/2Ba2+ |
63,64 |
1/2 СО32- |
69,3 |
|
1/2Ca2+ |
59,50 |
1/2SO42- |
80,0 |
Определим ионные подвижности в в следующих системах: «Са(HCO3)2 - Н2О», «NH4ОН- Н2О», «Са(OH)2 - Н2О», «NаOH - Н2О» , «СаСl2 - NaHCO3 - NH4OH - Н2О»; «Nа2СO3 - Н2О» «СаСl2 - NaHCO3 - NаOH - Н2О»; «СаСl2 - NaHCO3 – Nа2СO3 - Н2О»; «СаСl2 - NaHCO3 - Са(OH)2 - Н2О». Методика расчета описана в работе [1]. Данные расчетов представлены в таблице 2.
Таблица 2. Значения ионных подвижностей в различных системах
|
Система |
Ионная подвижность, см2/(Ом/г-экв) |
|
«Са(HCO3)2 - Н2О» |
1106,50 |
|
«NH4OH - Н2О» |
1611,80 |
|
«NаOH - Н2О» |
1062,78 |
|
«Nа2СO3 - Н2О» |
1136,70 |
|
«СаСl2 - NaHCO3 - NH4OH - Н2О» |
1496,03 |
|
«СаСl2 - NaHCO3 - NаOH - Н2О» |
1412,58 |
|
«СаСl2 - NaHCO3 – Nа2СO3 - Н2О» |
1700,80 |
|
«СаСl2 - NaHCO3 - Са(OH)2 - Н2О» |
1761,30 |
|
«СаСl2 - NaHCO3 - Са(OH)2 - Н2О» |
1761,30 |
|
«Са(HCO3)2 - Са(OH)2 - Н2О - NH4OH» |
1893,95 |
Из представленных расчетов можно сделать вывод, что введение раствора аммиака в систему, состоящую из СаСl2, NaHCO3, Са(OH)2, Н2О, увеличивает электропроводность системы на 7 %. Незначительное изменение величины ионной подвижности можно объяснить тем, что не было учтено влияние иона Н3O+ и аминных групп.
После расчета подвижности ионов проведем термодинамический анализ, который покажет вероятность образования СаСО3 для каждой из этих систем в состоянии термодинамического равновесия в широком интервале температур от 15 до 90 0С.
Исходя из данных расчетов ионной подвижности водных растворов, для изучения термодинамики образования карбоната кальция использовали модельный раствор с содержанием ионов кальция 76,15 мг/дм3, гидрокарбонат-ионов 240,27 мг/дм3 при рН раствора 7,88. Для приготовления модельного раствора использовали СаСl2, NaHCO3 квалификации ч.д.а., дистиллированную воду с величиной удельной электропроводности не более 5 мкСм/см.
Термодинамика определяет условия, при которых данный процесс становится возможным, устойчивым в тех или иных условиях, выясняет возможность уменьшения или предотвращения получения образующихся в реакциях веществ. Речь идет об ускорении или подавлении побочных реакций [7].
Химическая термодинамика рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают [4–6].
С помощью программы «Расчет равновесия химических реакций в широком интервале температур энтальпийным методом» [8] определяем величины энергии Гиббса (изобарно-изотермического потенциала) и констант равновесия (изобарно-изотермического потенциала), которые указывают на вероятность протекания процесса в прямом направлении. Исходные данные для термодинамических расчетов представлены в таблице 3.
Таблица 3. Исходные данные термодинамических расчетов [11]
|
Соединение |
∆Н298, кДж/моль |
∆G298, кДж/моль |
S298, Дж/моль·К |
|
Са2+ |
-542,66 |
-522,7 |
-55,23 |
|
НСО3- |
-691,28 |
-586,56 |
92,57 |
|
СаСО3(т) |
-1206,83 |
-1128,35 |
91,71 |
|
Н2О |
-285,83 |
-237,23 |
69,65 |
|
СО2 |
-393,51 |
-394,37 |
213,66 |
|
NH4+ |
-132,80 |
-79,52 |
112,84 |
|
ОН- |
-230,02 |
-157,35 |
-10,71 |
|
Na+ |
-240,03 |
-261,90 |
58,41 |
|
CO32- |
-674,64 |
-527,60 |
-56,04 |
Результаты термодинамических расчетов представлены в таблице 4.
Таблица 4. Данные термодинамических расчетов
|
Реакция |
∆G298, Дж/моль |
ℓgКр298 |
Кр298 |
|
СаСl2+2NаНСO3+2NH4ОН СаСО3↓+2NaCl+ (NH4)2CO3+2Н2О (1) |
-89831 |
16,01 |
1016,01 |
|
СаСl2+2NаНСO3+2NaОН→ СаСО3+2NaCl+Na2CO3+2Н2О (2) |
-89831 |
16,01 |
1016,01 |
|
СаСl2+2NаНСO3+Са(ОН)2→ 2СаСО3↓+2NaCl+2Н2О (3) |
-136353 |
24,30 |
1024,30 |
|
СаСl2+Nа2СO3 →СаСО3↓+2NaCl (4) |
407245 |
-72,59 |
10-72,59 |
|
2СаСl2+4NаНСO3+2NH4ОН+Са(ОН)2→ 3СаСО3+4NaCl+ (NH4)2CO3+4Н2О (5) |
-226184 |
40,32 |
1040,32 |
Численные значения констант равновесия указывают на возможность протекания химических реакций. Из выше приведенных реакций наиболее вероятно протекают реакции 1–3, 5.
Учитывая данные по инверсии пирамидального азота в аммиаке [3], в качестве жидкого катализатора для удаления солей временной жесткости был выбран водный раствор аммиака.
С помощью определителя Грама [2] определены следующие независимые реакции для процесса образования углекислого кальция с применением аммиачного раствора:
Са(НCO3)2+2NH4ОН↔СаСО3+(NH4)2СО3+2Н2О (6)
Са(НCO3)2+NH4ОН↔СаСО3+NH3+2Н2О+СО2 (7)
2NH3+Н2О+СО2↔(NН4)2СО3 (8)
CO2+NH3(р)+ Н2О(ж)↔ NH4HCO3 (9)
Были рассчитаны термодинамические параметры для указанных химических реакций. Результаты расчетов представлены в таблице 5.
Таблица 5. Результаты термодинамических расчетов для реакций процесса кристаллизации карбоната кальция
|
Реакция |
∆Н298, кДж/моль |
∆G298, кДж/моль |
lg Kp298 |
Kр |
|
Са(НCO3)2+2NH4ОН↔СаСО3+(NH4)2СО3+2Н2О |
-69,49 |
-120,39 |
15,80 |
1015,80 |
|
Са(НCO3)2+NH4ОН↔СаСО3+NH3+2Н2О+СО2 |
701,00 |
-80,97 |
8,88 |
108,88 |
|
2NH3+Н2О+СО2↔(NН4)2СО3 |
-185,00 |
-81,04 |
14,24 |
1014,24 |
|
2NH3+Н2О+СО2↔NН4НСО3 |
-98,28 |
-18 |
3,19 |
103,19 |
Значения констант равновесия и изобарно-изотермического потенциала данных реакций (∆G < 0, lg Kp > 0) свидетельствуют о возможности протекания процесса в прямом направлении для всех четырех реакций. Сравнивая константы равновесия реакций 6–9 (таблица 2), можно предположить, что наиболее вероятно протекание реакции (6).
Константы равновесия для реакций 6–9 можно представить в следующем виде:
![]()
![]()
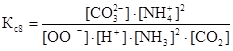
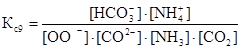
![]() ,
,
где ∆n – изменение молей газов в результате реакции.
Таким образом, используя значения констант равновесия с учетом закона постоянства атомов, были определены равновесные концентрации ионов. Были получены экспериментальные данные изменения концентрации ионов кальция в растворе в зависимости от концентрации ионов аммония. Далее были определены значения теоретических и экспериментальных данных по изменению концентрации ионов кальция в водном растворе. Результаты представлены на рисунке.
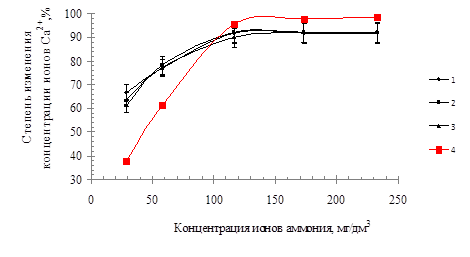
Рис. Зависимость степени изменения концентрации ионов кальция от исходной концентрации ионов аммония при различных температурах обрабатываемой воды: 1 – при температуре 40 0С, 2 – при температуре 20 0С, 3 – при температуре 30 0С, 4 – линия равновесных концентраций
Выводы
1. Установлено, что при введении в пересыщенный раствор гидрокарбоната кальция водного раствора аммиака увеличивается подвижность ионов на 7 %, за счет чего и интенсифицируется процесс образования кристаллов СаСО3;
2. Определены термодинамические параметры процесса образования карбоната кальция в интервале температур от 15 0С до 90 0С, а именно константы равновесия, энергия Гиббса, равновесные концентрации.
3. Впервые установлены равновесные и рабочие концентрации ионов Са2+, которые определяют движущую силу процесса кристаллизации карбоната кальция, что позволит рассчитать коэффициент массопередачи в дальнейшем;
4. Теоретическая и экспериментальная степени извлечения ионов Са2+ в твердую фазу составили, соответственно, 98,67 % и 92,11%.
Работа выполнена в рамках ФЦП "Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы" (государственный контракт №11.519.11.5025 от 12.03.2012 г.).
Рецензенты:
Иванчина Эмилия Дмитриевна, доктор технических наук, профессор, Федеральное агентство по образованию, ГОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Лотов Василий Агафонович, доктор технических наук, профессор, Федеральное агентство по образованию, ГОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.



