Использование бактерий для производства электроэнергии представляет собой новое направление в биоэнергетике. Микробные топливные элементы (МТЭ) представляют собой биоэлектрохимическую систему, работа которой основана на способности бактерий к разложению таких веществ, как глюкоза, ацетат, бутират или сточные воды. Благодаря их окислению высвобождаются электроны, которые передаются на анод, после чего по проводнику выработанный электрический ток поступает к катоду (рис. 1).
Идея использования микробных клеток в попытке производства электроэнергии была выдвинута М.С. Поттером еще в 1911 г. Эта технология долгое время не вызывала интереса ученых по причине своей крайне низкой производительности. Современная концепция устройства МТЭ была предложена лишь в 1977 году. Новое решение позволило повысить количество производимой реактором электроэнергии. С этого времени начинается процесс активного поиска оптимальных технических решений для эффективной работы МТЭ.
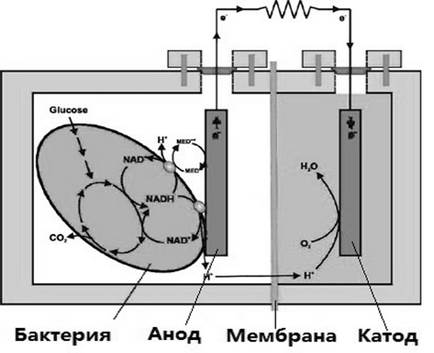
Рис. 1. Схема работы двухкамерного микробного топливного элемента.
Основная задача, стоящая перед исследователями, заключается в повышении количества производимой МТЭ электроэнергии при сокращении материальных затрат на поддержание работоспособности реактора. В ходе решения этой задачи возникает вопрос, какая бактериальная культура позволит МТЭ работать с наивысшей эффективностью. К настоящему моменту описано около десяти тысяч видов бактерий и предполагается, что их существует свыше миллиона, однако не все из них подходят для использования в работе микробных топливных элементов. Критерием отбора в данном случае будет являться способность бактерий разлагать органические вещества и передавать электроны из внутриклеточного пространства на анод. Для бактерий, используемых в работе МТЭ, характерно образование своеобразной биопленки, покрывающей электрод, таким образом, бактериальные клетки расположены на нем в несколько слоев и не все микроорганизмы находятся в непосредственном контакте с анодом. Процессы электрохимического взаимодействия разных слоев биопленки с анодом вызывают интерес многих исследователей в силу того, что эти процессы во многом определяют производительность МТЭ. Изучение прямого и косвенного электронного переноса от бактериальной клетки к аноду и факторов, влияющих на интенсивность этого процесса, может внести существенный вклад в проблему выведения бактериальной культуры, оптимальной для эффективной работы микробных топливных элементов.
Целью данной статьи является краткая характеристика электрохимических взаимодействий смешанных или чистых микробиологических культур, связанных с анодом, в том числе рассмотрение процессов переноса электронов в различных слоях анодной биопленки, поскольку интерпретация этих процессов является одним из ключевых факторов в решении проблемы повышения производительности МТЭ. Также рассматриваются факторы внутреннего строения бактериальной клетки, как потенциально влияющие на интенсивность электрохимического взаимодействия между анодом и биопленкой и, таким образом, влияющие на количество энергии, производимой бактериями в процессе работы микробного топливного элемента.
Характер этого взаимодействия может варьироваться в зависимости от стадии развития биопленки, состава микробного сообщества и количества производимой этой биопленкой электрической энергии [5; 7; 25; 26; 31; 34].
Механизмы прямого и косвенного электронного переноса были выявлены при исследовании металловосстанавливающих бактерий, которые используют нерастворимые оксиды железа в качестве конечного акцептора электронов [21; 26; 29]. Три основных известных способа переноса электронов (рис. 2) представляют собой:
1) перенос электронов посредством окислительно-восстановительного мобильного медиатора-шаттла [25; 26];
2) перенос электронов через проводящие фимбрии (так называемые нанопровода) [9];
3) прямой перенос электронов посредством особого мембранносвязанного комплекса [1].
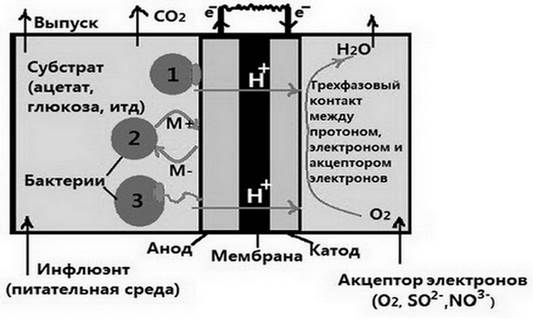
Рис. 2. Упрощенный вид двухкамерного микробного топливного элемента с возможными режимами переноса электронов: 1 - прямой перенос электронов (через внешние мембранные цитохромы); 2 - перенос электронов через шаттлы-посредники; 3 - перенос электронов через нанопровода.
В ранних исследованиях в МТЭ обычно добавлялись химические медиаторы или электронные шаттлы, в результате чего способность к переносу электронов обретали новые виды бактерий, для которых эта способность была не характерна. Эти растворимые экзогенные медиаторы, способствующие переносу электрона из клетки на электрод, включают, например, нейтральрот, антрахинон-2-6, дисульфонат (AQDS), тионин, феррицианид калия, метилвиологен и др. [2; 18; 23; 27]. Экзогенные электронные шаттлы, как правило, стабильны в окисленной и восстановленной форме, они не разлагаются и не являются токсичными. Однако работа МТЭ рассчитана на срок не менее полугода, и для таких временных рамок экзогенные химические медиаторы не применимы в силу того, что они могут ингибировать бактериальную культуру. К тому же их высокая стоимость и необходимость регулярно добавлять их в питательный раствор анодной камеры делают технологию МТЭ для очистки сточных вод и производства электроэнергии экономически не выгодной [10].
В то же время было доказано [25; 27], что необходимые для работы реактора-МТЭ медиаторы-шаттлы могут быть не только экзогенными, поскольку существуют бактерии, которые могут производить эндогенные химические медиаторы. Например, пиоцианин производится бактериями вида Pseudomonas aeruginosa и также может переносить электроны из клетки на электрод и участвовать в процессе производства электроэнергии в МТЭ. Смешанная бактериальная культура, в составе которой присутствует P. aeruginosa, может производить высокие концентрации медиаторов при низком внутреннем сопротивлении в МТЭ. Это достигается использованием феррицианида в качестве католита (вместо кислорода), в результате чего производительность МТЭ возрастает до 4,2 Вт/м2. Эти результаты свидетельствуют о возможности функционирования крупномасштабного МТЭ без добавления экзогенного медиатора.
Перенос электронов из бактериальной клетки к аноду возможен не только посредством экзогенных или эндогенных медиаторов-шаттлов. Некоторые виды бактерий, например Geobacter и Shewanella, способны сами производить проводящие фимбрии (пилусы), которые выступают в роли биологических нанопроводов для передачи электронов от бактериальной клеточной поверхности к акцептору [9]. Исследования структуры нанопроводов выявили существенные различия в их структуре. Пилусы Geobacter sulfurreducens выглядят как относительно тонкие нити (рис. 3), в то время как нанопровода Shewanella oneidensis имеют вид толстых «кабелей», которые потенциально могут состоять из нескольких токопроводящих нитей, сгруппированных вместе, и обладать более высокими проводящими способностями [29].
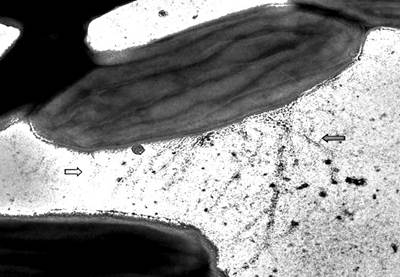
Рис. 3. Бактерия вида Geobacter sulfurreducens. Стрелки на фото указывают на пилусы-нанопровода.
Помимо железовосстанавливающих бактерий, существуют и другие организмы, которые способны производить электропроводные нанопровода. Этим качеством обладают фототрофные, кислородные цианобактерии (Synechocystis), которые также могут служить для производства электроэнергии МТЭ, но только в светлое время суток [10].
В процессе работы мембранносвязанного комплекса микроорганизм производит окислительно-восстановительный фермент, который остается неподвижным и располагается на клеточной стенке. Когда бактерии покрывающей электрод биопленки разлагают органический субстрат, окислительно-восстановительные ферменты клеточной стенки обеспечивают прямую передачу электронов. Примерами таких бактерий служат Geobacter sulfurreducens, Rhodoferax ferrireducens, Geobacter metallireducens и Aeromonas hydrophila [1; 4; 32].
Генетические исследования и электрохимический анализ показывают, что клетки, находящиеся в прямом контакте с анодом в МТЭ, взаимодействуют с ним через цитохром С, находящийся на внешней поверхности клетки [3; 13; 14; 17]. Между тем G. sulfurreducens может образовывать биопленки толщиной более 50 мкм, при этом все клетки в толще биопленки являются метаболически активными и вносят вклад в производство электроэнергии, разлагая органические вещества и передавая электроны на анод [3; 8; 22]. Исследователи считают, что производство микробных нанопроводов имеет важное значение для дальнего переноса электронов через толщу биопленки G. sulfurreducens (рис. 4) [30]. Предполагается, что производство электроэнергии толщей анодной биопленки возможно только в том случае, если вся толща является электропроводной [16; 20; 24]. Это явление само по себе необычно, поскольку считается, что большинство видов бактерий работает как изоляторы, а не проводники [6; 12]. Настоящим прорывом в этой области станет измерение электропроводности биопленки и определение компонентов, отвечающих за это свойство, а также факторов, оказывающих на него влияние.
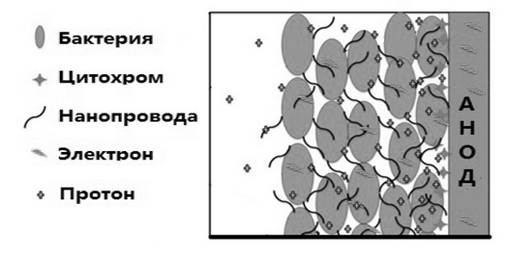
Рис. 4. В биопленке Geobacter sulfurreducens клетки, непосредственно контактирующие с электродом, передают электроны посредством цитохром, в то время как клетки, удаленные от электрода, могут использовать сеть нанопроводов.
Многочисленные исследования последних лет направлены на выведение такого бактериального штамма, который позволит МТЭ вырабатывать больше электроэнергии без добавления новых дорогостоящих катализаторов или электронных шаттлов [15]. Предпринимались попытки повысить производство электроэнергии в МТЭ путем создания штамма Geobacter с более интенсивным процессом метаболизма [19]. Дополнительное производство цитохромов или микробных нанопроводов не привело к увеличению мощности производства, равно как и создание потока АТФ (аденозинтрифосфат), по прогнозу метаболической модели ведущее к повышению метаболизма клетки. Адаптивная селекция в МТЭ имела больше успеха, увенчавшись производством штамма G. Sulfurreducens, названного KN400, который способен на 8-кратное увеличение удельной мощности. Интересно, что этот штамм производит более тонкую биопленку с меньшим количеством внешних цитохромов, но с обилием нанопроводов, что дает почву для новых исследований сложного процесса переноса электрона при высоких плотностях тока [33].
Таким образом, можно сказать, что один развитый бактериальный консорциум анодной биопленки может использовать одновременно разные способы переноса электронов на анод для разных слоев толщи биопленки. Более того, анализ характеристик способов переноса от бактериальной клетки к аноду позволяет сказать, что для эффективной работы МТЭ должен применяться не один способ переноса электрона, а оптимальная для данных условий комбинация способов. Наблюдения за работой МТЭ с участием различных искусственно выведенных штаммов бактерий показывают, что производство электроэнергии бактериями МТЭ является комплексным процессом, и для увеличения его масштабов требуется больше, чем изменения в нескольких генах или изменения интенсивности метаболизма бактериальной клетки. Несомненно, вопрос поиска оптимального бактериального штамма для более эффективной работы МТЭ с минимальными материальными затратами еще не решен и потребует более детальных исследований того, какие именно факторы и условия среды оказывают наибольшее влияние на производительность микроорганизмов в МТЭ.
Рецензенты:
Гончарук В.К., д.х.н., профессор, заведующий лабораторией оптических материалов, Институт химии ДВО РАН, г.Владивосток.
Алексейко Л.Н., д.х.н., профессор, ЗАО «Дальневосточный НИИ охраны природы», г.Владивосток.
Библиографическая ссылка
Жигула Е.А., Петухов В.И., Жигула Л.Д. ХАРАКТЕРИСТИКА ПРОЦЕССОВ ПЕРЕНОСА ЭЛЕКТРОНОВ МЕЖДУ АНОДНЫМ МИКРОБИОЛОГИЧЕСКИМ КОНСОРЦИУМОМ И АНОДОМ КАК КЛЮЧЕВЫХ ФАКТОРОВ ПРОИЗВОДИТЕЛЬНОСТИ МИКРОБНОГО ТОПЛИВНОГО ЭЛЕМЕНТА. // Современные проблемы науки и образования. 2013. № 4. ;URL: https://science-education.ru/ru/article/view?id=10008 (дата обращения: 15.11.2025).



