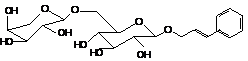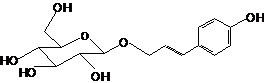В настоящее время осуществляется активный поиск лекарственных растений, обладающих иммуномодулирующей и антиоксидантной активностью [7]. В этом отношении большой интерес представляют лекарственные растения, содержащие фенилпропаноиды, для которых ранее обнаружены адаптогенные, тонизирующие, ноотропные, анксиолитические, антидепрессантные и иммуномодулирующие свойства [1-7, 9-11]. Ценным источником препаратов данного спектра биологической активности является сырье элеутерококка колючего [Eleutherococcus senticosus (Rupr. et Maxim.) Maxim.], эхинацеи пурпурной [Echinacea purpurea (L.) Moench.], родиолы розовой (Rhodiola rosea L.), лимонника китайского (Schizandra chinensis Bail.). Перспективными в этом плане являются также плоды расторопши пятнистой [Silybum marianum (L.) Gaertn.], кора ивы корзиночной Salix viminalis L., кора сирени обыкновенной (Syringa vulgaris L.), трава мелиссы лекарственной (Melissa officinalis L.) [10]. В плане поиска биологически активных соединений, в том числе фенилпропаноидов лекарственных растений, перспективным является компьютерное прогнозирование.
Цель настоящих исследований – компьютерное прогнозирование активности иммуномодулирующей и антиоксидантной активности некоторых фенилпропаноидов.
Прогнозируемый спектр биологической активности представлен в PASS в виде списка активностей с двумя вероятностями Pa («быть активным») и Pi («быть неактивным»), рассчитанных для каждой активности. При этом только активности с Pa>Pi считаются возможными для анализируемого соединения [8].
Материал и методы исследования
В качестве объектов исследования служили фармакопейные растения, лекарственное растительное сырье, фенилпропаноиды, выделенные из корневищ родиолы розовой (розавин, коричный спирт), корневищ элеутерококка колючего (сирингин, или элеутерозид В), коры сирени обыкновенной (сирингин), коры ивы корзиночной (триандрин, п-кумаровый спирт). В качестве препаратов сравнения использованы рутин и дигидрокверцетин, выделенные из травы гречихи посевной (Fagopyrum sagittatum Gilib.) и древесины лиственницы сибирской (Larix sibirica L.) соответственно.
В работе использованы тонкослойная хроматография, колоночная хроматография, спектрофотомерия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР-спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70%-ным этиловым спиртом, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению. Хроматографическую колонку (силикагель L 40/100) элюировали хлороформом и смесью хлороформ — этиловый спирт в различных соотношениях. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ — этанол (9:1), хлороформ — метанол —вода (26:14:3), а также н-бутанол — ледяная уксусная кислота — вода (4:1:2).
Результаты исследования и их обсуждение
В результате проведенных исследований из ЛРС выделены и охарактеризованы с использованием УФ-, ЯМР-спектроскопии, масс-спектрометрии, ТСХ и ВЭЖХ, различных химических превращений фенилпропаноиды – розавин, триандрин, сирингин (элеутерозид В), коричный спирт и п-кумаровый спирт, представляющие интерес с точки зрения химической стандартизации сырья и препаратов соответствующих лекарственных растений, а также проявления биологической активности. Изучены зависимости спектральных и фармакологических свойств ряда фенилпропаноидов от их химической структуры.
В ходе исследований с использованием программы PASS определено, что наиболее вероятное проявление иммуномодулирующей активности (Pa > Pi) гликозидов фенилпропаноидов (розавина, триандрина, сирингина), тогда как для агликонов (коричного спирта, п-кумарового спирта) это просматривается в меньшей степени (табл. 1).
Достаточно велика вероятность проявления и антиоксидантной активности фенилпропаноидов (табл. 2), хотя и в меньшей степени, чем в случае препаратов сравнения – антиоксидантов: Pa>Pi для дигидрокверцетина — 0,718 > 0,004, рутина — 0,753 > 0,004. Следует отметить, что данный прогноз коррелирует с результатами соответствующих экспериментальных исследований антиоксидантной, иммуномодулирующей и тонизирующей активности [2, 7].
Таблица 1
Прогноз иммуномодулирующей активности некоторых фенилпропаноидов (Pa > Pi)
|
Вещество
|
Химическая структура |
Pa |
Pi
|
|
Розавин
|
|
0.669 |
0.018 |
|
Триандрин |
|
0.595 |
0.037
|
|
Элеутерозид В (сирингин) |
|
0.567 |
0.046
|
|
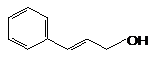
Коричный спирт |
|
0.470 |
0.098
|
|
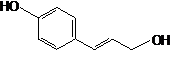
п-Кумаровый спирт |
|
0.434 |
0.133
|
Таблица 2
Прогноз антиоксидантной активности некоторых фенилпропаноидов (Pa > Pi)
|
Вещество
|
Химическая структура |
Pa |
Pi
|
|
Розавин
|
|
0.502 |
0.015 |
|
Триандрин |
|
0.533
|
0.012 |
|
Элеутерозид В (сирингин) |
|
0.431 |
0.023 |
|
Коричный спирт |
|
0.470 |
0.098
|
|
п-Кумаровый спирт |
|
0.383 |
0.031 |
Таким образом, лекарственные растения, содержащие фенилпропаноиды розавин, триандрин и сирингин (элеутерозид В), являются перспективным источником антиоксидантных и иммуномодулирующих лекарственных средств.
Вывод
Обоснована целесообразность создания и внедрения конкурентоспособных антиоксидантных и иммуномодулирующих лекарственных препаратов на основе сырья родиолы розовой, ивы корзиночной, элеутерококка колючего и сирени обыкновенной, содержащих фенилпропаноидные гликозиды (розавин, триандрин, сирингин).
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, заведующий кафедрой фармацевтической технологии государственного бюджетного образовательного учреждения высшего профессионального образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева Государственного бюджетного образовательного учреждения высшего профессионального образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Библиографическая ссылка
Куркин В.А., Поройков В.В. ФЕНИЛПРОПАНОИДЫ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ: ПРОГНОЗ АНТИОКСИДАНТНОЙ И ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТИ // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=22694 (дата обращения: 14.02.2026).