В настоящее время сердечно-сосудистые заболевания (ССЗ) являются ведущими причинами смерти во всем мире. Самая распространенная причина ИБС – атеросклероз коронарных артерий. Тем не менее, по разным данным, примерно у 50% пациентов с дискомфортом в груди, характерным для стабильной стенокардии, и у 10–20% пациентов с острым коронарным синдромом при ангиографическом исследовании не выявляются признаки обструктивной ИБС [1–3]. По данным одного из исследований, у 44,5% из 925 пациентов при проведении плановой диагностической коронароангиографии (КАГ) были выявлены неизмененные или малоизмененные коронарные артерии [4]. Еще в одном исследовании у 14,6% пациентов также не было выявлено их изменений [5].
Данное состояние впервые описал Н. Kemp в 1973 г. и назвал термином «Кардиальный синдром Х» (КСХ) [6]. Кроме этого, использовались и другие определения. В последующем, когда было выяснено, что основную роль в развитии данной патологии играют структурные и функциональные изменения коронарных микрососудов, R.O. Cannon, S.E. Epstein в 1988 г. ввели термин «микрососудистая стенокардия» [7].
Стандартного согласованного определения КСХ не существует [8]. В последние годы наибольшее распространение получил термин «микрососудистая стенокардия (МСС)». По современным данным, МСС характеризуется типичной ангинозной болью в груди, депрессией сегмента ST на электрокардиограмме во время выполнения упражнений и интактными коронарными артериями при ангиографии [9].
Этиология и патогенез. Известно, что МСС чаще встречается у женщин. В ретроспективном когортном исследовании с использованием проспективно собранных ангиографических и клинических данных 32 856 пациентов в Британской Колумбии и Канаде было обнаружено, что у 23,3% женщин по сравнению с 7,1% мужчин коронарные артерии были нормальными [10]. Другое исследование показало, что у женщин диагностировали неизмененные коронарные артерии более чем в 5 раз чаще, чем у мужчин (41% против 8%) [11]. Причем у женщин с МСС симптомы стенокардии появляются, как правило, в перименопаузе или менопаузе [12].
Большой объем данных указывает на то, что важную роль в возникновении ишемии миокарда у пациентов с МСС играет коронарная микрососудистая дисфункция (МСД), которая может быть обнаружена при многих сердечных или системных заболеваниях, например при кардиомиопатиях, коронарном атеросклерозе, иммунологических состояниях, системной гипертензии. В этом случае говорят о «вторичной» микрососудистой стенокардии [13]. Однако у многих пациентов МСД является единственным или преобладающим фактором, ответственным за возникновение приступов стенокардии и ишемии миокарда. Такое состояние определяется как «первичная» МСС [14]. Патогенез МСС до сих пор остается неясным, тем не менее, были предложены две основные гипотезы: 1) ишемия в результате эндотелиальной дисфункции (ЭД); 2) аномальная сердечная болевая чувствительность. Ишемия миокарда, вызванная дисфункцией микрососудов, была изучена как основная причина МСС [15]. Считается, что пациенты с таким синдромом имеют нарушение релаксации и/или повышенную чувствительность к сужению сосудов в интрамуральных артериолах и преартериолах [16].
При МСС имеет место структурная, функциональная или вегетативная несостоятельность мелких сосудов. Структурные изменения – ремоделирование микроваскулярного русла либо его обструкция вследствие микроэмболизации. К функциональным причинам относят ЭД, а также нарушение коронарной микрососудистой дилатации и повышенную активность микрососудистых констрикторов. Вегетативные причины – усиленные адренергические влияния или нарушение парасимпатической системы [17].
Существуют разнообразные причины, которые вызывают ЭД у больных с МСС: нарушение функции эндотелиоцитов и их апоптоз, хронический воспалительный процесс, сопровождающийся повышением маркеров воспаления (СРБ, ИЛ-6, ФНО-α), усиление процессов свободного окисления [18], усиленная агрегация тромбоцитов, изменение вегетативной регуляции тонуса артерий [19, 20]. Кроме этого, ЭД связана со снижением уровня оксида азота и повышением уровня эндотелина-1. Экспериментальным путем установлен еще один возможный механизм развития ЭД. Было выявлено, что растворимый гликопротеин дипептидилпептидаза-IV ослабляет эндотелийзависимую релаксацию сосудов вследствие стимуляции высвобождения тромбоксана А2 и, таким образом, непосредственно приводит к нарушению функции эндотелия [21].
Другим важным патогенетическим механизмом развития МСС является снижение порога восприятия боли. Значимую роль играет также и нарушение метаболизма аденозина, его повышенное накопление может привести к смещению сегмента ST и повышенной чувствительности к болевым раздражителям [22, 23]. S.D. Rosen et al. обнаружили, что у пациентов с МСС вследствие адренергического дисбаланса имеются усиленная кардиальная афферентная стимуляция и нерегулируемая передача ноцицептивных стимулов к коре головного мозга [24, 25].
Дефицит эстрогена у женщин в постменопаузе долгое время считался одной из ведущих причин МСС [26, 27]. Известно, что эстрогены обладают анальгезирующим действием через μ-опиоидные рецепторы, а значит, вследствие их дефицита у женщин с МСС снижается порог болевой чувствительности. В исследовании Кедры-Синайского медицинского центра и SRM – института науки и техники, включившем 53 женщины, M. Agarwal и соавт. [28] установили, что у женщин с МСС дислипидемия и индекс массы тела являются независимыми предикторами снижения резерва миокардиального кровотока. Кроме этого, предиктором снижения фракционного резерва кровотока является уровень гомоцистеинемии [29].
Очень интересной является работа японских исследователей, которые установили, что у пациентов с дисфункцией коронарных микрососудов (ДКМ) чаще встречаются LOF-аллели (*2, *3) цитохрома P450 2C19 с медленным типом метаболизма (CYP2C19 PM). Только у женщин повышение уровня высокочувствительного СРБ и указанный тип полиморфизма CYP2C19 имели прогностическое значение для развития ДКМ. Возможно, генотип CYP2C19 PM является одним из факторов риска ДКМ в женской популяции [30].
Совсем недавно было выяснено, что у пациентов с МСС уровень витамина D в сыворотке крови значительно ниже, чем у тех, у кого нет этого состояния. Дефицит витамина D может быть фактором риска, потенциально связанным с усилением воспаления, ведущим к развитию эндотелиальной дисфункции и МСС [31].
Клиника. МСС характеризуется типичными приступами стенокардии. Однако у женщин, особенно моложе 55 лет, могут быть атипичные боли в грудной клетке, без четкой связи с физической нагрузкой, или вообще стенокардия может быть безболевой [32]. У данных пациентов стенокардия имеет тенденцию быть более продолжительной и с более медленным (>10–15 мин) разрешением боли в груди после прекращения упражнений и/или после введения нитратов короткого действия по сравнению с приступами стенокардии у пациентов с ИБС [33].
Диагностика. Группой COVADIS были предложены диагностические критерии МСС в виде триады признаков: 1) боль в груди (стенокардия), в основном при нагрузке (иногда также в состоянии покоя); 2) ишемические изменения на электрокардиограмме (ЭКГ) – депрессия сегмента ST во время нагрузочного теста или других неинвазивных тестов на выявление ишемии миокарда; 3) нормальные или малоизмененные коронарные артерии при КАГ [14].
Диагноз МСС у пациентов с повторяющейся болью в груди и отсутствием каких-либо ангиографических поражений более 50% в любом коронарном сосуде – это, прежде всего, диагноз исключения [34]. В первую очередь необходимо исключить боль в груди некардиального происхождения (например, при заболеваниях желудочно-кишечного тракта, скелетно-мышечных, легочных или психических заболеваниях). Кроме этого, первичная МСС подлежит дифференцировке с неатеросклеротическими изменениями коронарных артерий (вторичная МСС) и коронароспазмом [35].
Изменения на ЭКГ, позволяющие заподозрить данный синдром, характеризуются депрессией сегмента ST на 1 мм и более, выявленной при проведении пробы с физической нагрузкой, или более 1,5 мм и продолжительностью более 1 мин, установленной при 48-часовом мониторировании ЭКГ [36]. При проведении стресс-эхокардиографии с физической нагрузкой или добутамином появляются депрессия сегмента ST на ЭКГ и/или болевые ощущения за грудиной, но отсутствуют региональные нарушения сократимости стенки левого желудочка [14, 26].
Поскольку сосуды, участвующие в микроциркуляции, слишком малы, то КАГ не позволяет адекватно визуализировать микрососудистое русло. Для подтверждения диагноза МСС эксперты Европейского общества кардиологов рекомендуют использовать «коронарный резерв кровотока» (КРК). Это показатель, который определяется как максимальное независимое от эндотелия расширение микрососудов и увеличение КРК, которое достигается при внутривенном введении аденозина (0,14 мкг/кг/мин) или дипиридамола (0,84 мг/кг за 6 мин). КРК<2,0 считается диагностическим признаком наличия микрососудистой дисфункции, а значения более 2,0, но менее 2,5 имеют пограничную диагностическую значимостью [37]. Одним из наиболее надежных и точных методов неинвазивной оценки МСД является позитронно-эмиссионная томография. Однако ограниченная доступность в клинической практике и высокая стоимость метода исключают его широкое применение для рутинного обследования пациентов с МСС [38].
Еще одним неинвазивным методом оценки коронарного резерва является МРТ сердца с контрастрованием коронарных артерий гадолинием. Преимуществами этого метода служат отсутствие ионизирующего излучения и высокая разрешающая способность. Использование гадолиний-усиленной стресс-МРТ с аденозином позволяет определить субэндокардиальные дефекты перфузии, возникающие из-за феномена коронарного обкрадывания, в областях миокарда с неадекватной микроциркуляцией. Однако при оценке субэндокардиальных слоев миокарда возникают артефакты, которые сложно дифференцировать от реальных дефектов перфузии миокарда [39]. На изображении (A) стрессовой перфузии (рис.) наблюдался индуцируемый дефект перфузии миокарда (>25% миокарда, стрелки). В состоянии покоя дефект перфузии отсутствует (изображение B) [40].
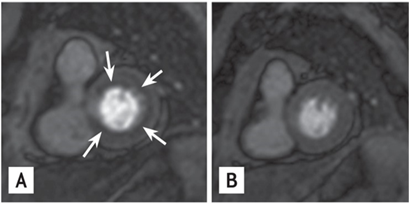
Аденозин-перфузионная магнитно-резонансная томография у пациентов с микрососудистой стенокардией
Основополагающим методом верификации ишемии миокарда у больных с МСС является однофотонная эмиссионная компьютерная томография сердца, совмещенная с нагрузочным или фармакологическим тестом [41].
Лечение. Выбор оптимального лечения больных с МСС представляет сложную задачу. Это связано с тем, что патогенетические механизмы МСС до конца не ясны, а также не проводилось крупных рандомизированных исследований, оценивающих эффективность терапии.
Пациентам с МСС, имеющим дислипидемию, необходимо назначать лечение статинами.
В настоящее время вопрос о назначении дезагрегантов больным МСС до конца не разрешен. Согласно Европейским рекомендациям пациентам с МСС рекомендуют назначать ацетилсалициловую кислоту, однако эти данные также не подтверждены никакими исследованиями.
Исследования показали, что иАПФ уменьшают выраженность и частоту болевых ощущений, улучшают толерантность к физической нагрузке, функцию эндотелия, скорость коронарного кровотока и могут быть использованы в лечении МСС [9, 34].
Учитывая роль гормонального дисбаланса в развитии МСС у женщин, можно предположить, что заместительная терапия эстрогенами может быть полезной в лечении данного заболевания. К сожалению, пока нет клинических исследований, которые могли бы оценить безопасность гормональной терапии у женщин с МСС.
Из антиангинальных препаратов наиболее эффективными считаются бета-адреноблокаторы [42]. Известно, что они уменьшают ЧСС и снижают потребность миокарда в кислороде, кроме этого, оказывают положительное влияние на функцию эндотелия. Было показано, что они улучшают симптомы стенокардии, функциональные возможности и нагрузочные тесты у 75% пациентов с МСС. Имеются данные, что метопролол может улучшать функцию эндотелия у пациентов с МСС за счет снижения уровня селектина и эндотелина-1. Наибольшую доказанную эффективность в лечении МСС показал высокоселективный бета-адреноблокатор небиволол [43].
Применение пролонгированных нитратов улучшает состояние больных, но их истинная эффективность оказалась умеренной и не зависела от воздействия на функцию микрососудов сердца [44]. Поэтому нитраты не рекомендуются в качестве терапии первой линии у пациентов с МСС.
Имеются данные о хорошей эффективности в терапии МСС никорандила, ранолазина, ивабрадина. В исследовании, проведенном нашим соотечественником в 2017 г., в качестве медикаментозного лечения была предложена комбинация ранолазина и никорандила, которая оказала хорошую эффективность: уменьшились количество приступов болей и их продолжительность [40].
Учитывая данные о том, что у больных с МСС часто встречаются тревожно-депрессивные расстройства и повышенное восприятие боли, многие исследователи отмечали хороший клинический эффект антидепрессантов [24].
В качестве терапии МСС, который сопровождается дефицитом витамина D, инъекции витамина D3 в течение 2 месяцев (300000 единиц) значительно улучшили течение заболевания и уменьшили признаки ишемии миокарда.
Применение аминофиллина, блокирующего аденозиновые рецепторы, уменьшает количество эпизодов ангинальных болей и улучшает переносимость физической нагрузки [9].
Доказана эффективность кардиореабилитации у больных МСС. Добавление 4-недельного курса кардиологической реабилитации может увеличить показатель беговой дорожки Duke и продолжительность теста с физической нагрузкой, а также улучшить миокардиальный кровоток [45].
Заключение. В последнее время микрососудистая стенокардия находит все большее признание в клинической практике. Диагностика синдрома сложна и дорога, патогенез до конца не изучен. Важно проведение дополнительных исследований, направленных на детальное изучение патогенеза и разработку доступных методов диагностики патологических изменений коронарных микрососудов с акцентом на неинвазивные методики, внедрение в клиническую практику гадолиний-усиленной стресс-МРТ, позволяющей выявлять субэндокардиальные дефекты перфузии. В качестве эффективных лекарственных препаратов можно рекомендовать бета-адреноблокаторы, ранолазин, никорандил, ивабрадин, ингибиторы АПФ, витамин D.
Библиографическая ссылка
Горшенина Е.И., Иневаткина Ю.Н., Куркина Н.В., Селезнева Н.М., Скоробогатова Л.Н. МИКРОСОСУДИСТАЯ СТЕНОКАРДИЯ // Современные проблемы науки и образования. – 2021. – № 3. ;URL: https://science-education.ru/ru/article/view?id=30835 (дата обращения: 26.04.2024).



