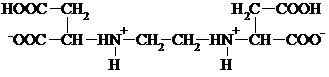
Ранее в [7] получены данные об устойчивости средних комплексов эддяк с алюминием lgβ = 13,5. Однако в работе не упоминается о возможном существовании протонированных комплексов. Также не рассматривалось влияние ионной силы на комплексообразование. Для выявления концентрационной зависимости констант устойчивости нами были проведены исследования системы эддяк - Al3+ - вода при различных значениях ионной силы и рассчитаны термодинамические константы устойчивости этилендиаминдисукцинатов алюминия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для расчета величин lgβ использовали метод потенциометрического титрования при нескольких значениях ионной силы в среде KNO3 и температуре 298.2 K.
Эддяк синтезировали взаимодействием этилендиамина с малеиновой кислотой [5]. Рабочие растворы (0,005 М) готовили по навеске сухого комплексона в день эксперимента. Концентрацию контролировали методами потенциометрического и комплексонометрического титрования. Раствор нитрата алюминия готовили из навески солей квалификации «ч.д.а.», концентрацию устанавливали комплексонометрически. Раствор нитрата калия готовили по навеске KNO3 марки «х.ч.». Бескарбонатный 0,05 M раствор NaOH готовили из 50%-ного раствора NaOH растворением необходимого количества в предварительно прокипяченной воде с последующей стандартизацией. Для расширения рабочего диапазона рН использовали стандартный раствор азотной кислоты, приготовленный из концентрированной НNO3 и стандартизированный по тетраборату натрия.
Потенциометрические измерения с точностью ±0.05 ед. рН проводили с помощью рН-метра-милливольтметра рН-410 «Аквалон» с использованием комбинированного рН-электрода ЭСЛК-01.7 «Аквилон». Систему калибровали по стандартным буферным растворам со значениями рН, равными 1,68 и 9,18. Титрование проводили в термостатированной ячейке при 298,2 К. Величину ионной силы изменяли добавлением необходимого количества нитрата калия. Число параллельных измерений составляло не менее четырех раз.
Экспериментальные данные обрабатывали с помощью универсальной компьютерной программы AUTOEQUIL [6], алгоритм которой позволяет провести определение значимых комплексных форм из общей выборки допустимых форм и вычислить соответствующе константы образования в режиме автоматического поиска модели, адекватной рН-метрическим данным.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Соотношение концентраций Al3+ и H4L в исследуемых растворах составляло 1:1. Кривые титрования систем сAl : cэддяк = 1:1 (рис. 1, кривая 2) отличались от кривой титрования кислоты H4L (рис. 1, кривая 1) уже с самых начальных значений pH, т.е. наряду со ступенчатой диссоциацией H4L в изучаемой системе протекали процессы комплексообразования. Также было проведено титрование системы сAl : cэддяк = 1:2. Характер кривых совпадает, следовательно, можно сделать вывод об отсутствии билигандных комплексов в системе. Поэтому все дальнейшие измерения проводили только при соотношении сAl : cэддяк = 1:1.
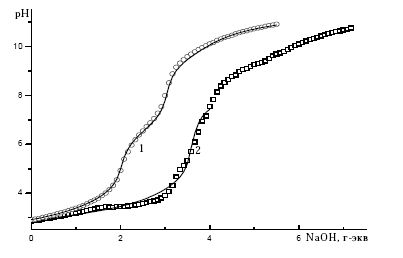
Рис. 1. Кривые потенциометрического титрования растворов: H4L (0,0010 моль/л) (1); Al3+ : H4L = 1:1 (2). Титрант - 0,0510 М NaOH (T = 298.2 K, ионная сила 0,5 (KNO3)). Точки - эксперимент, линии - расчет
Полученные кривые титрования можно разделить на две области. В кислой и средней областях рН было обнаружено образование протонированных и средних комплексов. В щелочной области рН явно протекают процессы с образованием различных гидроксокомплексов, однако получить модель, адекватно описывающую эту область кривой титрования, не удалось. Поэтому расчет вели при рН меньше 7.
При проведении расчетов за базисные частицы были приняты H+, L4ˉ, Al3+. Учитывали процессы кислотно-основного взаимодействия:
H2O ↔ H+ + OHˉ, (1)
H4L ↔ H+ + H3Lˉ, (2)
H3Lˉ↔ H+ + H2L2ˉ, (3)
H2L2ˉ↔ H+ + HL3ˉ, (4)
HL3ˉ ↔ H+ + L4ˉ, (5)
Al3+ + OHˉ↔ AlOH2+, (6)
AlOH2+ + OHˉ ↔Al(OH)2+, (7)
Al(OH)2+ + OHˉ↔ Al(OH)3, (8)
Al(OH)3 + OHˉ↔ Al(OH)4ˉ. (9)
Использовались константы диссоциации H4L и гидролиза алюминия, полученные при различных ионных силах раствора в тех же условиях, в которых проводились исследования процессов взаимодействия алюминия с эддяк. Полученные значения хорошо согласуются между собой и с литературными данными [3; 4; 8]. Результаты проведенного исследования представлены в таблице 1. В процессе определения констант гидролиза алюминия было выявлено, что в условиях эксперимента концентрация частицы AlOH2+, образующейся по реакции (6), пренебрежимо мала. Поэтому при расчете констант устойчивости комплексов это равновесие не учитывалось.
Найденные значения lgβ реакций образования этилендиаминдисукцинатов алюминия при 298.2 К и I = 0,1; 0,5; 1,0 (KNO3) представлены в таблице 1.
Таблица 1 - Логарифмы констант устойчивости lg β при 298.2 К
|
Реакция |
I |
|||
|
0 |
0.1 |
0.5 |
1,0 |
|
|
AlOH2+ + OHˉ ↔ Al(OH)2+ |
9.0* [8] |
9.13 ± 0.10 |
8.99 ± 0.20 |
8.93 ± 0.10 |
|
Al(OH)2+ + OHˉ↔ Al(OH)3 |
8.5* [8] |
7.94 ± 0.10 |
7.37 ± 0.10 |
7.36 ± 0.10 |
|
Al(OH)3 + OHˉ ↔ Al(OH)4ˉ |
4.6* [8] |
4.63 ± 0.10 |
4.58 ± 0.20 |
4.58 ± 0.20 |
|
L4ˉ + H+ ↔HL3ˉ |
10.73 ± 0.16 11,12 [3] |
10.02 ± 0.02 9,82 [4] |
9,65 ± 0.02 |
10,03 ± 0.03 10.10 [3] |
|
HL3ˉ + H+ ↔H2L2ˉ |
7.23 ± 0.07 7,52 [3] |
6,70 ± 0.02 6,83 [4] |
6,57 ± 0.03 |
6,89 ± 0.04 6.65 [3] |
|
H2L2ˉ+ H+ ↔ H3Lˉ |
4.01 ± 0.09 4.28 [3] |
3.68 ± 0.03 3.86 [4] |
3.57 ± 0.03 |
3,88 ± 0.05 3.81 [3] |
|
H3Lˉ + H+ ↔ H4L |
2.68 ± 0.2 3.45 [3] |
2.68 ± 0.05 2,40 [4] |
2.50 ± 0.09 |
3.03 ± 0.07 3.28 [3] |
|
Al3+ + HL3ˉ ↔ AlHL |
9.19 ± 0.2 |
7.29 ± 0.2 |
7.38 ± 0.07 |
7.41 ± 0.2 |
|
Al3+ + L4ˉ ↔ AlLˉ |
16.27 ± 0.07 |
13,86 ± 0.1 13,52 [7] |
13.15 ± 0.06 |
13,39 ± 0.1 |
* значения пересчитаны из констант гидролиза
По результатам исследования были построены диаграммы распределения различных комплексных форм Al3+ с H4L (рис. 2).

Рис. 2. Концентрационные диаграммы распределения комплексных форм Al3+ с H4L
Концентрационные константы равновесий зависят от условий проведения эксперимента. Больший интерес представляют термодинамические константы β0, являющиеся более объективными характеристиками ионных равновесий, независимые от природы и концентрации растворителя. Их величины были вычислены путем экстраполяции данных (рис. 3), полученных при фиксированных значениях ионной силы, на нулевую ионную силу по уравнению с одним индивидуальным параметром [2]:
![]() ,
,
где βc и β0 - концентрационные и термодинамические константы устойчивости соответственно; ΔZ2 - разность квадратов зарядов продуктов реакции и исходных частиц, Aγ - постоянная предельного закона Дебая, равная 0,5108 [1] при 298.2 К; I - ионная сила раствора; b - эмпирический коэффициент.
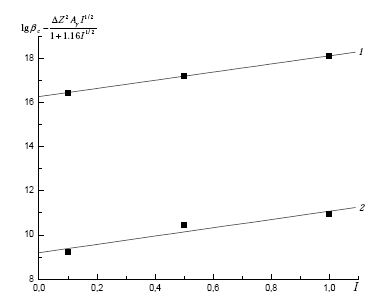
Рис. 3. Графическое определение термодинамической константы устойчивости комплексов при 298.2 К: 1 - AlL, 2 - AlHL
Полученные термодинамические константы устойчивости (табл. 1) могут быть использованы для надежной интерпретации результатов калориметрических исследований процессов комплексообразования с участием этилендиамин-N,N´-диянтарной кислоты.
Рецензенты:
- Каплунов И.А., д.т.н., профессор, генеральный директор ООО «Фотоника» Минобрнауки РФ, г. Тверь.
- Никольский В.М., д.х.н., профессор, генеральный директор малой инновационной фирмы «АНДРОНИК» Минобрнауки РФ, г. Тверь.
Работа получена 29.07.2011
Библиографическая ссылка
Толкачева Л.Н. КОНЦЕНТРАЦИОННЫЕ И ТЕРМОДИНАМИЧЕСКИЕ ХАРАКТЕРИСТИКИ КОМПЛЕКСООБРАЗОВАНИЯ AL3+ С ЭТИЛЕНДИАМИН-N,N´-ДИЯНТАРНОЙ КИСЛОТОЙ В ВОДНЫХ РАСТВОРАХ // Современные проблемы науки и образования. – 2011. – № 3. ;URL: https://science-education.ru/ru/article/view?id=4710 (дата обращения: 26.04.2024).



