Генетическая изменчивость ферментов антиоксидантной системы организма в последнее время стала одним из наиболее привлекательных объектов в изучении этиопатогенеза ССЗ. В настоящий момент известно, что активные формы кислорода (АФК), включающие процессы перекисного окисления, являются причиной инициации ишемической болезни сердца (ИБС) [2].
Сложный механизм формирования клинического фенотипа ИБС, а в частности, острого инфаркта миокарда (ОИМ) и стенокардии напряжения (СН), обусловлен большим количеством различных генов, вовлеченных в патогенез ИБС, однако роль генов, кодирующих ферменты антиоксидантной системы (АОС), при ИБС является недостаточно изученной, а результаты исследований, как правило, носят противоречивый характер [8, 9].
В связи с этим, целью данной работы является анализ ассоциации полиморфизма некоторых генов антиоксидантной системы (CAT, GPx-1, SOD2, SOD3), а также прооксидантного гена NADPH-оксидазы с риском развития ишемической болезни сердца у населения Республики Татарстан.
Материалы и методы. Генотипирование по полиморфным локусам было проведено у 431 человек (табл.1). Группа больных с диагнозом ИБС, состоящая из 266 человек, сформирована на базе кардиологических отделений Межрегионального клинико-диагностического центра (МКДЦ) и Городской больницы скорой медицинской помощи №1 (г. Казань), с учетом пола, возраста, отягощенной наследственности по ИБС (наличие ИБС у кровных родственников). Контрольная группа сравнения (ИБС «-») включала 165 человек, куда вошли пациенты МКДЦ без патологии сердечно-сосудистой системы. У всех пациентов было получено согласие на проведение данного исследования. Как больные, так и лица группы контроля представляли собой смешанную популяцию Республики Татарстан и не состояли друг с другом в кровном родстве.
Таблица 1. Характеристика обследованных групп
|
Признак |
ИБС «+» |
ИБС «-» |
|
|
ОИМ |
СН |
||
|
Численность |
174 |
92 |
165 |
|
Возраст |
63,4 ± 11,8 |
62,9 ± 11,3 |
59,9 ± 11,7 |
|
Мужчины/женщины |
104/70 |
37/55 |
81/84 |
Выделение геномной ДНК осуществляли из 5 мл венозной крови стандартным методом фенольно-хлороформной экстракции [1]. Генотипирование ДНК-полиморфизмов генов проводили методом ПЦР с последующим рестрикционным анализом согласно протоколам, описанным в литературе [3, 4, 7] на программируемых термоциклерах «MyCycler» (Bio-Rad Laboratories, США). Визуализацию и учет результатов генотипирования проводили с использованием гель документирующей системы ChemiDocтм XRS (Bio-Rad Laboratories, США).
Статистическая обработка данных проводилась с помощью программы UNPHASED версии 3.1.5 (программа разработана Frank Dudbridge, 2006, MRC Biostatistics Unit Robinson Way Cambridge CB2 0SR, UK). Значимость различий между группами по частотам встречаемости аллелей и генотипов исследованных полиморфизмов оценивали по критерию χ2 при уровне значимости р=0.05. Для оценки вклада полиморфных локусов в развитие ИБС рассчитывали отношение шансов (ОШ) и 95 % доверительных интервалов для ОШ (ДИОШ) по указанной выше программе.
Результаты и обсуждение
Главным патогенетическим фактором ИБС является стенозирующее атеросклеротическое поражение коронарных артерий сердца. Согласно перекисной концепции развития атеросклероза, при воздействии неблагоприятных факторов среды, нарастает образование активного кислорода, одним из основных источников образования которого является NADPH-оксидаза. АФК запускают механизмы свободно-радикального окисления (СРО), что приводит к деформации мембранного липопротеидного комплекса и нарушению мембранной проницаемости. Для регулирования процессов СРО в организме существует антиоксидантная система (АОС), которая включает в себя серосодержащие соединения, витамины, антиоксидантные комплексоны, гормоны, структурные антиоксиданты и ферментные системы - каталазу, супероксиддисмутазы, глутатионпероксидазу [5].
В данной работе проведены ассоциативные исследования по выявлению роли однонуклеотидных замен (SNP) в генах каталазы (САТ, полиморфизм -262 С/T, rs1001179), глутатион-пероксидазы-1 (GPx-1, полиморфизм +593С/T, rs1050450), митохондриальной супероксиддисмутазы (SOD2, полиморфизм +9T/C, rs4880), внеклеточной супероксиддисмутазы (SOD3, полиморфизм +186C/T, rs699473), осуществляющих антиоксидантную защиту организма, а также полиморфизма +242C/T гена NADPH-оксидазы (NADPH), продукт которого является одним из источников образования активных форм кислорода в клетке, в формировании генетической предрасположенности к клиническим формам ИБС (ОИМ И СН).
В проведенного анализа показано, что все исследованные полиморфизмы находятся в соответствии с равновесием Харди-Вайнберга (р>0,05).
Сравнительный анализ распределения частот аллелей и генотипов по всем исследованным локусам выявил различия между группами больных с различной клинической формой течения и условно здоровых лиц по полиморфизмам генов САТ, Gpx-1 и SOD2, тогда как по полиморфизмам генов SOD3 и NADPH статистически значимых различий между группами больных и контроля не обнаружено (рис. 1).
Так, в группе условно здоровых лиц по полиморфизму -262С/T гена САТ, локализованному в промотрной области гена, наблюдается статистически значимое увеличение частоты встречаемости генотипа АА, который оказывает протективное действие в отношении развития ИБС (ОШ<1), тогда как генотип ТТ является маркером повышенного риска развития ИБС, причем у таких носителей более чем в 7 раз увеличен риск протекания заболевания в форме стенокардии, тогда как вероятность развития ОИМ у таких же индивидов увеличена приблизительно в 2 раза. При этом предрасполагающий к стенокардии эффект данного аллеля и генотипа наиболее выражен у женщин (ОШ=6,2; 95 % ДИ 1,89- 12,18) (табл. 2). Необходимо также отметить, что генетически детерминированная предрасположенность к гипертонической болезни показана для носителей аллеля Т и генотипов ТТ+АТ в нескольких популяциях [3, 10].
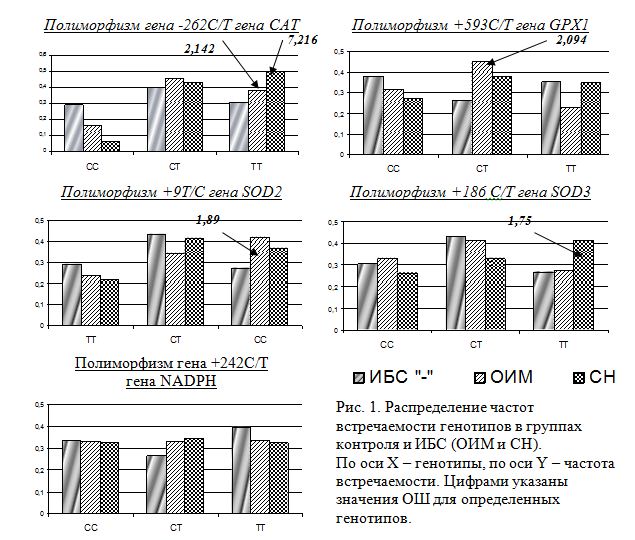
Также гендерные различия были обнаружены и для полиморфизма +593С/T гена Gpx-1, характеризующегося заменой Pro197Leu в последовательности белка. Так, при сравнении групп больных и контроля, в группе с ОИМ нами отмечено увеличение частоты встречаемости гетерозиготного генотипа CT (ОШ=2,094; 95 % ДИ 1,231-3,564), при этом статистически значимое увеличение частоты встречаемости этого генотипа наблюдается только у мужчин. Таким образом, носительство гетерозиготного генотипа более чем в 2 раза повышает риск развития ОИМ (ОШ=2,099; 95% ДИ 1,008-4,37). По данным ряда авторов, генотип СТ является маркером повышенного риска различных патологий сердечно-сосудистой системы, в том числе атеросклероза коронарных сосудов [6].
Предрасполагающим фактором к развитию ОИМ также является носительство генотипа CC полиморфного маркера +9T/C гена SOD2 (приводящей к замене Ala16Val в аминокислотной последовательности белка). Частота встречаемости данного генотипа увеличена в группе больных с ОИМ (ОШ=1,899; 95 %ДИ 1,09-3,32), при этом предрасполагающий к ОИМ эффект данного генотипа наиболее выражен также у мужчин (ОШ=2,26; 95 %ДИ 1,03-4,98) (табл. 2).
Особый интерес представляет полиморфизм +186C/T гена SOD3 (замена аргинина на глицин в 213ом положении полипептидной цепи), так как предрасполагающий эффект полиморфных вариантов данного SNP носит четкие гендерные различия. Так, у женщин со СН наблюдается достоверное увеличение частоты аллеля Т на фоне снижения частоты встречаемости аллеля С (p=0,003) и достоверное увеличение доли гомозиготного генотипа ТТ (р=0,011). При этом риск развития стенокардии напряжения у женщин, носителей генотипа TT, увеличен практически в 4 раза по сравнению с контрольной группой (ОШ=3,6; 95 % ДИ 1,38-9,40) (табл. 2).
По полиморфному варианту +242C/T гена NADPH, несмотря на некоторые изменения в распределении частот аллелей и генотипов между исследованными группами как больных с диагнозом ОИМ, СН и контроля, так и разделенных по гендерному признаку группах, статистически достоверных различий получено не было (табл. 2).
Таблица 2. Сравнительная характеристика частот аллелей и генотипов по исследованным локусам в группах ИБС и условно здоровых лиц
|
Генотип |
Мужчины |
Женщины |
||||||||
|
р* |
ОИМ |
ИБС«-» |
СН |
р** |
р* |
ОИМ |
ИБС«-» |
СН |
р** |
|
|
Полиморфизм -262С/T гена CAT |
||||||||||
|
СС СТ ТT |
0.01935 0.3652 0.2624 |
0.1635 0.4615 0.37 |
0.3086 0.3951 0.2963 |
0.05405 0.4595 0.4865 |
0.002255 0.8694 2.982 |
0.1311 0.6336 0.4051 |
0.1714 0.2738 0.3857 |
0.2738 0.4048 0.3214 |
0.07273 0.4 0.5273 |
0.003386 0.9554 0.01554 |
|
Полиморфизм +593С/T гена GPx-1 |
||||||||||
|
СС СТ ТТ |
0.3856 0.008128 0.05268 |
0.3204 0.4563 0.2233 |
0.3836 0.2603 0.3562 |
0.2973 0.3514 0.3513 |
0.3716 0.3204 0.9602 |
0.3356 0.01969 0.154 |
0.3043 0.4493 0.2464 |
0.3797 0.2658 0.3544 |
0.2545 0.4 0.3455 |
0.129 0.1017 0.9147 |
|
Полиморфизм +9T/C гена SOD2 |
||||||||||
|
ТТ ТС СС |
0.376 0.112 0.011 |
0.25 0.37 0.39 |
0.31 0.48 0.21 |
0.19 0.43 0.38 |
0.176 0.62 0.054 |
0.394 0.311 0.081 |
0.21 0.31 0.47 |
0.27 0.39 0.33 |
0.24 0.4 0.36 |
0.622 0.933 0.713 |
|
Полиморфизм +186C/T гена SOD3 |
||||||||||
|
СС СТ ТТ |
0.28 0.33 0.941 |
0.359 0.35 0.291 |
0.284 0.42 0.296 |
0.405 0.243 0.351 |
0.19 0.065 0.55 |
0.536 0.641 0.905 |
0.275 0.478 0.246 |
0.321 0.441 0.238 |
0.167 0.389 0.444 |
0.043 0.549 0.011 |
|
Полиморфизм +242С/Т гена NADPH |
||||||||||
|
СС СТ ТТ |
0.3665 0.6479 0.1924 |
0.3684 0.2947 0.3368 |
0.3026 0.2632 0.4342 |
0.3243 0.3784 0.2973 |
0.815 0.2101 0.1613 |
0.2291 0.1579 0.8368 |
0.2712 0.3898 0.339 |
0.3699 0.3562 0.274 |
0.3273 0.3273 0.3455 |
0.6174 0.5135 0.9 |
р* - данные cравнения группы ОИМ с группой ИБС «-».
р** - данные сравнения группы СН с группой ИБС «-».
Таким образом, определенные генотипы полиморфных локусов генов каталазы и супероксиддисмутазы 3 являются маркерами развития ишемической болезни сердца, а именно, стенокардии напряжения у женщин, тогда как аллельные сочетания по полиморфизмам генов Gpx-1 и SOD2 маркируют повышенный риск развития острого инфаркта миокарда у мужчин.
Рецензенты:
- Каримова Ф.Г., д.б.н., профессор, заслуженный деятель науки РТ, КИББ КазНЦ РАН, Российская Федерация, г. Казань.
- Ослопов В.Н., д.м.н., профессор, РФГОУ ВПО Казанский медицинский государственный университет, Российская Федерация, г. Казань.
Библиографическая ссылка
Майкова Е.В., Нгуен Ф.Н., Алимова Ф.К., Подольская А.А., Кравцова О.А. РОЛЬ ПОЛИМОРФНЫХ ВАРИАНТОВ ГЕНОВ АНТИОКСИДАНТНОЙ СИСТЕМЫ В ФОРМИРОВАНИИ ПРЕДРАСПОЛОЖЕННОСТИ К ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА // Современные проблемы науки и образования. – 2012. – № 1. ;URL: https://science-education.ru/ru/article/view?id=5301 (дата обращения: 26.04.2024).



