В настоящее время создание и изучение новых эффективных лекарственных препаратов является одним из главных и приоритетных направлений в фармацевтической индустрии. Поиск нового биологически активного соединения определяет основной процесс разработки инновационного лекарственного препарата и требует последующего подтверждения эффективности и безопасности изучаемого соединения.
В настоящее время особый интерес в качестве источника безопасных и эффективных лекарственных препаратов представляют пиримидиновые соединения [1-3]. Как известно, пиримидиновые основания имеют сходство со структурой оснований нуклеиновых кислот, играют важную роль во многих биологических процессах, что определяет наличие у них сочетания нескольких видов фармакологической активности. Кроме этого, установлено, что производные пиримидина, оказывая широкое фармакологическое действие, отличаются безопасностью [4-6]. Установлено, что препараты пиримидиновых производных используются в качестве терапевтических средств в лечении различных заболеваний, а именно психоневрологических, инфекционных, хирургических, онкологических и других. Кроме этого, данные соединения обладают противосудорожной, ноотропной, антидепрессивной и другими видами психотропной активности. Доказано, что пиримидиновые производные обладают анаболической активностью, оказывают противовоспалительное, антиоксидантное, спазмолитическое действие, ускоряют процессы репаративной регенерации, стимулируют клеточные и гуморальные факторы иммунитета, активизируют фагоцитоз и др. [7-9]. Наряду с вышеуказанным пиримидиновые соединения способны оказывать и противоинфекционное действие, включающее противомикробный, противовирусный, противогрибковый, противопротозойный эффекты [10-12].
Учеными Волгоградского государственного медицинского университета синтезированы пиримидиновые производные, одним из которых является соединение 3-[2-(1-Нафтил)-2-оксоэтил]хиназолин-4(3Н)-он (VMA–13–04), имеющее в структуре бензильный и α-нафтильный радикалы. Было установлено, что данное соединение оказывает иммунотропную и противомикробную активность. В связи с чем для определения возможности использования данного вещества в роли фармакологически активного необходимо провести оценку его острой токсичности.
Цель исследования: доклиническая оценка острой токсичности потенциального лекарственного средства пиримидинового производного 3-[2-(1-Нафтил)-2-оксоэтил]хиназолин-4(3Н)-он (VMA–13–04) с иммунотропной и противомикробной активностью при однократном интрагастральном введении лабораторным крысам.
Материал и методы исследования. Оценка острой токсичности исследуемого пиримидинового соединения проводилась на 50 нелинейных крысах-самцах 5-6-месячного возраста с массой от 220 до 250 г. Крысы на протяжении всего эксперимента содержались в стандартных условиях вивария ФГБОУ ВО «Астраханский ГМУ» Минздрава России. В процессе исследований животные находились на стандартном режиме питания со свободным доступом к воде (ГОСТ Р 50258-92) при естественном освещении. Температура воздуха в виварии поддерживалась на уровне +18-22 °С.
Содержание животных соответствовало правилам лабораторной практики (ГОСТ З 51000.3-96 и 51000.4-96) и Приказу МЗ РФ № 199н от 01.04.2016 г. «Об утверждении правил надлежащей лабораторной практики». Все манипуляции с животными проводили в соответствии с требованиями Директивы Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях (2010/63/EU), правилами, принятыми «Международной конвенцией по защите позвоночных животных, используемых для экспериментальных и научных целей» (Страсбург, 1986).
Все животные были разделены на группы:
˗ первая группа (контроль) – животные, получавшие интрагастрально эквиобъем дистиллированной воды;
˗ опытные группы, включающие животных, получавших пиримидиновое соединение в дозах 500; 1000; 2000; 4000 мг/кг в виде суспензии интрагастрально.
Возможные проявления острой токсичности оценивали ежедневно в течение 14 суток после введения соединения на основе оценки общего и психического состояния, двигательной активности, массы тела, состояния волосяного, кожного покрова и слизистых оболочек. Психическое состояние животных оценивали по результатам проведения теста «Порсолт». Согласно «Методическим указаниям по изучению общетоксического действия фармакологических веществ» после выведения животных из эксперимента был проведен патоморфологический анализ внутренних органов, гематологический анализ и биохимическое исследование крови животных.
При патоморфологическом исследовании внутренних органов проводили макроскопический анализ и их взвешивание.
Гематологический анализ крови выполняли на основе мазков крови, окрашенных по Романовскому-Гимзе. Биохимические показатели в сыворотке крови (общий белок, билирубин общий (аланинаминотрансфераза (АЛТ), аспартатаминотранфераза (АСТ)) оценивали на полуавтоматическом биохимическом анализаторе (Torus 1200 Dixion, Россия).
Статистическую обработку результатов исследования осуществляли с помощью пакетов программ: Microsoft Office Excel 2007 (Microsoft, США), BIOSTAT 2008 Professional 5.1.3.1. (Analyst-Soft Inc., США). При обработке полученных результатов использовали параметрический метод с определением t-критерия Стьюдента с поправкой Бонферрони. Различия в группах сравнения оценивали при постоянно выбранном уровне значимости p ≤ 0,05.
Результаты исследования и их обсуждение
Результаты изучения общего состояния лабораторных животных представлены в таблице 1.
Таблица 1
Изменение общего состояния животных на фоне введения пиримидинового производного VMA–13–04
|
Группы животных |
Изучаемые показатели |
|||
|
Общее состояние |
Волосяной покров |
Кожные покровы |
Гибель животных всего/умерло |
|
|
Контроль |
+ |
+ |
+ |
10/0 |
|
VMA–13–04 (500 мг/кг) |
+ |
+ |
+ |
10/0 |
|
VMA–13–04 (1000 мг/кг) |
+ |
+ |
+ |
10/0 |
|
VMA–13–04 (2000 мг/кг) |
± |
+ |
+ |
10/0 |
|
VMA–13–04 (4000 мг/кг) |
± |
+ |
+ |
10/0 |
Примечание: «+» - положительная оценка; «±» - сомнительный показатель.
При оценке острой токсичности пиримидинового производного 3-[2-(1-Нафтил)-2-оксоэтил]хиназолин-4(3Н)-он (VMA–13–04) было установлено, что изучаемая субстанция в дозах 500 и 1000 мг/кг не вызвала изменений общего состояния, волосяного и кожного покрова и слизистых оболочек. Новое соединение в дозах 2000 и 4000 мг/кг способствовало снижению двигательной активности животных в течение первых суток, однако на следующие сутки эти проявления нивелировались.
Следует отметить, что при изучении острой токсичности не было отмечено гибели лабораторных животных, в связи с чем уровень полулетальной дозы невозможно определить. Принимая во внимание полученные результаты, в качестве LD50 была принята максимальная доза 4000 мг/кг. Таким образом, новое пиримидиновое производное 3-[2-(1-Нафтил)-2-оксоэтил]хиназолин-4(3Н)-он (VMA–13–04) является малотоксичным веществом и относится к 4 классу токсичности.
При проведении теста «Порсолт» было установлено, что производное пиримидина в дозах 500, 1000, 2000 мг/кг практически не оказывало влияния, показатели остались приближенными к контрольным значениям. Изучаемое соединение в дозе 4000 мг/кг вызывало снижение длительности латентного периода до первой иммобильности крыс в 1,4 раза в сравнении с контролем; отмечено увеличение продолжительности иммобильности животных в 2,2 раза по сравнению с контрольными животными. Полученные результаты свидетельствуют о возможном развитии тревожно-депрессивного состояния лабораторных животных на фоне введения производного пиримидина VMA–13–04 в дозе 4000 мг/кг.
Результаты оценки изменения двигательной активности, характеризующей выраженность депрессивного состояния животных, представлены в таблице 2.
Таблица 2
Влияние пиримидиного производного VMA–13–04 на поведение крыс-самцов в тесте «Порсолт»
|
Группы животных |
Показатели теста |
||||
|
Длительность латентного периода до первого движения животных, c |
Длительность латентного периода до первой иммобильности животных, с |
Длительность иммобильности животных, с |
Пассивное плавание, с |
Активное плавание, с |
|
|
Контроль |
22,8±4,3 |
76,3±4,7 |
7,1±1,01 |
53,4±2,3 |
132,6±6,8 |
|
VMA–13–04 (500 мг/кг) |
23,9±1,5 |
77,9±6,5 |
6,3±1,3 |
55,7±2,6 |
128,9±7,4 |
|
VMA–13–04 (1000 мг/кг) |
24,5±1,7 |
79,9±6,8 |
6,9±1,03 |
56,3±4,9 |
129,2±8,9 |
|
VMA–13–04 (2000 мг/кг) |
20,9±2,3 |
69,8±4,8 |
8,3±1,1 |
52,7±4,1 |
131,9±10,3 |
|
VMA–13–04 (4000 мг/кг) |
24,9±3,9 |
54,3±4,1** |
15,6±3,2*** |
55,4±5,1 |
131,8±9,2 |
Примечание: * - p<0,05; ** - p<0,01; *** - p<0,001 - относительно контроля.
Динамика массы тела лабораторных животных на фоне введения пиримидинового производного VMA–13–04 представлена на рисунке.
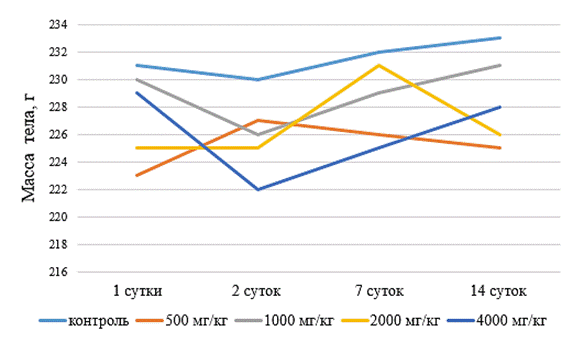
Динамика массы тела белых крыс на фоне введения пиримидинового производного VMA–13–04
При интрагастральном введении изучаемого пиримидинового производного было установлено, что масса тела животных в период наблюдения практически не изменялась. Введение соединения пиримидина в дозах 2000 и 4000 мг/кг на вторые сутки вызывало снижение массы тела, однако статистической значимости данные изменения не имели.
Макроскопический анализ внутренних органов лабораторных животных (головной мозг, желудок, печень, сердце, тимус, надпочечники, селезенка), проведенный после выведения крыс из эксперимента, показал, что новое соединение в диапазоне доз от 500 до 4000 мг/кг не вызывало изменения массы внутренних органов, появления гиперемии, кровоизлияний и некроза.
Результаты анализа изменений гематологических показателей на фоне введения VMA–13–04 представлены в таблице 3.
Таблица 3
Изменение гематологических показателей на фоне введения пиримидинового производного VMA–13–04
|
Группы животных |
Гематологические показатели |
|||
|
Эритроциты |
Гемоглобин, г/л |
Лейкоциты |
Тромбоциты |
|
|
Контроль |
7,3±1,1 |
126±8,7 |
9,8±1,4 |
423,9±18,6 |
|
VMA–13–04 (500 мг/кг) |
6,9±1,1 |
122±5,8 |
9,6±1,1 |
420,5±15,3 |
|
VMA–13–04 (1000 мг/кг) |
6,4±0,9 |
121±4,9 |
9,5±1,2 |
418,8±17,1 |
|
VMA–13–04 (2000 мг/кг) |
6,3±1,2 |
120±5,7 |
8,4±1,2 |
415,7±17,2 |
|
VMA–13–04 (4000 мг/кг) |
6,0±0,9 |
116±4,8 |
8,0±1,1 |
411,6±16,1 |
При оценке изменений гематологических показателей лабораторных животных было установлено, что повышение дозы пиримидинового производного приводит к снижению количества эритроцитов, лейкоцитов, тромбоцитов и уровня гемоглобина, однако полученные результаты не имели статистической значимости.
Результаты анализа изменений биохимических показателей на фоне введения VMA–13–04 представлены в таблице 4
Таблица 4
Изменение биохимических показателей на фоне введения пиримидинового производного VMA–13–03
|
Группы животных |
Биохимические показатели |
|||
|
Общий белок |
Билирубин общий |
АЛТ |
АСТ |
|
|
Контроль |
92,4±6,3 |
7,63±1,4 |
76±5,3 |
258,3±18,3 |
|
VMA–13–04 (500 мг/кг) |
92,3±6,8 |
7,62±1,8 |
79±5,9 |
263,4±21,5 |
|
VMA–13–04 (1000 мг/кг) |
92,6±6,7 |
7,88±1,8 |
80±6,8 |
268,3±22,4 |
|
VMA–13–04 (2000 мг/кг) |
88,8±7,4 |
8,01±1,9 |
83±6,8 |
273,6±24,1 |
|
VMA–13–04 (4000 мг/кг) |
86,2±5,9 |
9,97±1,7* |
105±9,4* |
305,4±25,3* |
Примечание: * - p<0,05 - относительно контроля.
При определении биохимических показателей крови животных было установлено, что производное пиримидина в дозах 500, 1000 и 2000 мг/кг не способствует статистически значимым изменениям со стороны таких показателей, как белок общий, билирубин общий, АЛТ, АСТ. В то же время исследуемое соединение в дозе 4000 мг/кг привело к увеличению уровня билирубина общего и АЛТ в сравнении с контрольной группой животных на 24% (р˂0,05) и 38% (р˂0,05) соответственно.
Заключение. Таким образом, оценка острой токсичности нового производного пиримидина 3-[2-(1-Нафтил)-2-оксоэтил]хиназолин-4(3Н)-он (VMA–13–04) показала, что данное соединение относится к малотоксичным веществам. Однако данное соединение в дозе 4000 мг/кг способствовало развитию изменений со стороны показателей, характеризующих ферментативные билиарные нарушения, что делает необходимым дальнейшее изучение хронической токсичности исследуемого пиримидинового производного.
Исследование выполнено в рамках государственного задания Министерства здравоохранения РФ в части проведения НИР по теме «Поиск и разработка перспективных соединений с антибактериальной активностью среди производных пиримидина для создания лекарственных препаратов» 48.2-2021.



